Тема 4 ОКСИДЫ И КИСЛОТЫ
Оксиды – сложные вещества, молекулы которых состоят из атомов двух элементов, одним из которых является кислород, имеющий отрицательную степень окисления.
Кислород – самый электроотрицательный элемент после фтора, поэтому он имеет отрицательную степень окисления и образует оксиды почти со всеми элементами. Соединение фтора с кислородом 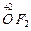 , в котором степень окисления кислорода +2, к оксидам не относится, его называют фторид кислорода.
, в котором степень окисления кислорода +2, к оксидам не относится, его называют фторид кислорода.
В оксидах связь между атомами ковалентная. Чем больше разность электроотрицательности элемента и кислорода, тем больше полярность связи между ними. В оксидах активных металлов она ближе к ионной, а в оксидах неметаллов связь ковалентная слабополярная.
Оксиды делятся на несолеобразующие (или безразличные), солеобразующие, смешанные, пероксиды. К несолеобразующим относятся те оксиды, которые не реагируют с водой с образованием кислот и оснований, а также не реагируют с кислотами и со щелочами с образованием солей, например: СО, NO, N2O.
Кислоты – это электролиты, которые в водном растворе могут диссоциировать с образованием ионов гидроксония Н3О+ и анионов кислотного остатка, причем, кроме катионов гидроксония, других катионов не образуются.
Кислоты делятся на бескислородные и кислородсодержащие. К бескислородным относятся HCl, HBr, HI, H2S. Кислородсодержащие кислоты представляют собой продукты присоединения молекул воды к молекулам ангидридов, т. е. являются гидроксидами. К ним относятся H2SO4, HNO3, H3PO4, HNO2, H2SO3, HClO4 и др.
Вариант 1
1. Составьте формулы высших оксидов цинка, бора, селена, лития. Укажите тип каждого из оксидов.
2. Определите по степени окисления хлора в кислотах HClO, HClO2, HClO3, HClO4 ангидриды этих кислот.
3. Доведите до конца уравнение реакции:
CO2 + Ca (OH)2 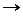
4. Напишите уравнение реакции взаимодействия между оксидом железа (II) и соляной кислотой.
Вариант 2
1. Напишите формулы оксидов хрома для степеней окисления +2, +3, +6. Укажите, к какому из типов относятся эти оксиды.
2. Определите формулы кислот, соответствующих ангидридам SO2, SO3, N2O3, N2O5, P2O3. Напишите названия этих кислот, укажите состав и заряд кислотных остатков.
3. Доведите до конца уравнение реакции:
MgO + H3PO4 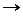
4. Напишите уравнение реакции взаимодействия между оксидом калия и оксидом кремния (IV).
Вариант 3
1. Приведите формулы высших оксидов хлора, стронция, вольфрама и алюминия. Определите тип каждого из оксидов.
2. Напишите формулы названия и укажите основность кислот, соответствующих следующим ангидридам: SO3, P2O3, N2O5, SiO2, CrO3.
3. Доведите до конца уравнение реакции:
N2O5 + KOH 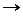
4. Напишите уравнение реакции взаимодействия между оксидом калия и ортомышьяковой кислотой.
Вариант 4
1. Перечислите оксиды хлора, отвечающие степеням окисления +1, +3, +5 и +7, и формулы кислородсодержащих кислот хлора, соответствующих этим оксидам.
2. Приведите примеры следующих кислот: двухосновной бескислородной, одно- и трехосновной кислородсодержащих. Укажите названия этих кислот, определите по формулам степень окисления кислотообразователя, а также состав и заряд кислотного остатка.
3. Допишите до конца уравнение реакции: SO2 + KOH 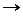
4. Напишите уравнение реакции взаимодействия оксида алюминия с азотистой кислотой.
Вариант 5
1. Составьте общие формулы высших оксидов элементов первой, третьей, четвертой и шестой групп. Пользуясь этими формулами, приведите примеры основного амфотерного и кислотных оксидов.
2. Напишите формулы кислот, соответствующих ангидридам N2O3, N2O5, SiO2, P2O5 и укажите их названия.
3. Допишите до конца уравнение: MgO + H3AlO3 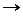
4. Напишите уравнения реакции взаимодействия между серным ангидридом и едким натром.
Вариант 6
1. Приведите формулы высших оксидов цезия, свинца, хрома, хлора. Укажите тип каждого из этих оксидов.
2. Доведите до конца уравнение реакции получения оксидов при нагревании природного минерала меди и малахита:
Cu2(OH)2CO3 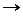
3. Определите формулы кислот, отвечающих ангидридам N2O5, CrO3, SO2, P2O5; укажите их названия, покажите состав и заряды кислотных остатков.
4. Напишите уравнение реакции взаимодействия между оксидом калия и ортофосфорной кислотой.
Вариант 7
1. Приведите по два примера основных, кислотных и амфотерных оксидов (для элементов различных групп и периодов). Напишите формулы кислоты и основания, соответствующих одному из амфотерных оксидов.
2. Напишите формулы, укажите названия и основность кислот, соответствующих ангидридам: CO2, N2O3, P2O5.
3. Доведите до конца уравнение реакции: K2O + N2O5 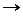
4. Напишите уравнение реакции взаимодействия между оксидом алюминия и йодисто-водородной кислотой.
Вариант 8
1. Напишите формулы высших оксидов бора, титана, сурьмы, марганца.
2. Определите ангидриды кислот H4P2O7, HClO4, HBO2 и H2MoO4 по степени окисления кислотообразователя.
3. Доведите до конца уравнение реакции: Ag2O + HNO3 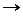
4. Напишите уравнение реакции взаимодействия сернистого ангидрида с едким натром.
Вариант 9
1. Напишите формулы оксидов марганца для степеней окисления +2, +4, +7. Укажите, какой из оксидов является кислотным, основным, амфотерным.
2. Приведите формулы и названия всех известных кислот, образуемых фосфором и серой. Укажите их основнсоть; определите в каждой из кислот степень окисления кислотообразователя.
3. Доведите до конца уравнение реакции: Na2O + H3PO4 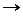
4. Напишите уравнение реакции взаимодействия между оксидом углерода (IV) и гашеной известью.
Вариант 10
1. Составьте общие формулы и приведите примеры высших оксидов элементов третьей – седьмой групп.
2. По степени окисления кислотообразователя определите состав ангидридов следующих кислот: HPO4, H4P2O7, H3PO3, H3PO4. Напишите названия кислот и ангидридов.
3. Приведите уравнение реакции гашеной извести.
4. Напишите уравнение реакции взаимодействия между оксидом хрома (III) и серной кислотой.
Вариант 11
1. Напишите формулы оксидов азота в степени окисления +1, +2, +3 и +5. Подчеркните кислотные оксиды и укажите соответствующие им кислоты.
2. Приведите уравнения реакций взаимодействия основного оксида с кислотой и кислотного оксида с основанием (по выбору).
3. Для сернистой, бромистоводородной, ортомышьяковой и пирофосфорной кислот заполните таблицу:
| Кислота | Кислотообразователь | Кислотный остаток | Ангидрид кислоты |
4. Доведите до конца уравнение реакции: Al2O3 + HNO3 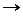
Вариант 12
1. Составьте формулы высших оксидов лития, ванадия, молибдена.
2. Определите по степени окисления кислотообразователя состав ангидридов кислот H2Cr2O7, HPO3, H2SiO3, H2CrO4.
3. Доведите до конца уравнение реакции: N2O5 + KOH 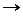
4. Напишите уравнение реакции взаимодействия между оксидом кальция и ортофосфорной кислотой.
Вариант 13
1. Приведите примеры оксидов элементов четвертого периода (основных, амфотерных, кислотных).
2. Доведите до конца уравнение реакции получения оксидов: ZnS + O2 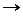
3. Для сероводородной, азотистой, кремниевой и ортофосфорной кислот заполните таблицу:
| Кислота | Кислотообразователь | Кислотный остаток | Ангидрид кислоты |
4. Напишите уравнение реакции взаимодействия между оксидом железа (III) и сернистой кислотой.
Вариант 14
1. Напишите общие формулы оксидов для элементов первой – седьмой групп и по одному из примеров под ними. Подчеркните основные оксиды одной прямой чертой, кислотные – двумя, амфотерные – волнистой линией.
2. Доведите до конца уравнение реакции получения оксидов: MgCO3 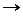
3. Напишите формулы кислот, отвечающих ангидридам N2O3, CO2, P2O5, а также укажите состав и заряды кислотных остатков.
4. Приведите уравнения реакции взаимодействия между оксидами натрия и кремния (IV). Объясните, почему эти оксиды могут при определенных условиях реагировать друг с другом.
Дата добавления: 2015-09-11; просмотров: 1957;
