Тема 6 ОСНОВНЫЕ ЗАКОНЫ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ: ТЕПЛОВЫЕ ЭФФЕКТЫ, СКОРОСТЬ РЕАКЦИИ, ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Вариант 1
1.Дайте понятие энергии активации.
2.Как нужно изменить концентрацию вещества В, чтобы скорость газофазной реакции А + 3В 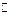 АВ3 увеличилась в 1000 раз?
АВ3 увеличилась в 1000 раз?
3.Какую роль играет катализаторы в химических реакциях?
Вариант 2
1.Сформулируйте правило Вант-Гоффа.
2.Во сколько раз возрастет скорость газофазной реакции А + 3В 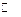 АВ3 при увеличении давления в 5 раз?
АВ3 при увеличении давления в 5 раз?
3.При растворении в воде какого вещества происходит выделение теплоты?
1) Na2CO3; 2) Na2CO3 × 10H2O; 3) NH4NO3; 4) NaCl.
Вариант 3
1. Что такое температурный коэффициент реакции?
2. Реакция при температуре 20°С протекает за 6 мин 45 с. За какое время закончится эта реакция при температуре 60°С?
3. На скорость химической реакции между раствором серной кислоты и железом не оказывает влияния:
1) концентрация кислоты; 3) температура реакции;
2) измельчение железа; 4) увеличение давления.
Вариант 4
1.Охарактеризуйте понятие скорости химической реакции. От каких факторов зависит скорость химической реакции?
2.Реакция при температуре 30°С протекает за две минуты сорок секунд. При температуре 70°С эта же реакция протекает за десять секунд. Чему равен температурный коэффициент реакции?
3.Взаимодействие какой пары веществ будет протекать с большой скоростью?
1) Pb и HCl; 3) Zn и HCl;
2) Fe и HCl; 4) Mg и HCl.
Вариант 5
1.Сформулируйте принцип Ле-Шателье.
2.Химическое равновесие сместится в сторону образования продуктов как при понижении температуры, так и при повышении давления в системе:
1) 4 NH3(Г) + 5 О2(Г) 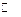 4 NO (Г) + 6 Н2О (Г) + Q;
4 NO (Г) + 6 Н2О (Г) + Q;
2) 2 SO2(Г) + О2(Г) 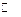 2 SO3(Г) + Q;
2 SO3(Г) + Q;
3) N2O3(Г) 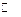 NO (Г) + NO2(Г) – Q;
NO (Г) + NO2(Г) – Q;
4) C (ТВ) + 2 NO2(Г) 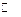 СО2 + 2 N2(Г) + Q.
СО2 + 2 N2(Г) + Q.
3. Какой из факторов не оказывает влияния на скорость химической реакции в растворах?
1) концентрация веществ;
2) использование катализаторов;
3) использование ингибиторов;
4) объем реакционного сосуда.
Вариант 6
1.Какие факторы влияют на обратимость химических реакций?
2.Какое вещество необходимо добавить, чтобы сместить равновесие в реакции
Сl2 + H2O 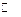 HCl + HClO в сторону образования продуктов реакции?
HCl + HClO в сторону образования продуктов реакции?
3.Во сколько раз изменится скорость элементарной реакции 2А + В ® А2В, если концентрацию вещества А уменьшить в 2 раза?
Вариант 7
1.Что называется теплотой образования вещества?
2.Реакция, химическое равновесие которой сместится в сторону образования исходных веществ как при понижении температуры, так и при повышении давления:
1) N2(Г) + О2(Г) 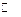 2 NO (Г) – Q;
2 NO (Г) – Q;
2) 2 SO3(Г) 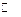 2 SO2(Г) + О2(Г) – Q;
2 SO2(Г) + О2(Г) – Q;
3) 4 HCl (Г) + О2(Г) 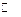 2 Сl2(Г) + Н2О (Г) +Q;
2 Сl2(Г) + Н2О (Г) +Q;
4) 2 CO (Г) + О2(Г) 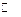 2 СО2(Г) + Q.
2 СО2(Г) + Q.
3. Сколько теплоты выделяется или поглощается при образовании 1 моль NO2 в результате реакции, термохимическое уравнение которой таково:
2 NO + O2 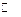 2 NO2 + 113,7 КДж.
2 NO2 + 113,7 КДж.
Вариант 8
1.Сформулируйте закон Гесса
2.Реакция, химическое равновесие которой сместится в сторону образования исходных веществ как при повышении температуры, так и при понижении давления:
1) 2 NO (Г) + SO2(Г) 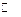 NO2(Г) + SO3(Г) + Q;
NO2(Г) + SO3(Г) + Q;
2) NO (Г) + SO3(Г) 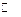 SO2(Г) + NO2(Г) – Q;
SO2(Г) + NO2(Г) – Q;
3) N2(Г) + О2(Г) 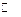 2 NO (Г) – Q;
2 NO (Г) – Q;
4) 3 Fe2O3(Г) + Н2О (Г) 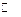 2 Fe3O4(Г) + Н2О (Г) + Q.
2 Fe3O4(Г) + Н2О (Г) + Q.
3. Сколько килоджоулей теплоты выделится при образовании 2 молей оксида алюминия, полученного в результате реакции:
3 Fe3O4(К) + 8 Al (К) ® 9 Fe (К) + 4 Al2O3(К) + 3330 КДж.
Вариант 9
1.Что такое внутренняя энергия вещества?
2.Дано термохимическое уравнение:
2 Mg + O2 ® 2 MgO + 1204 КДж
Сколько теплоты выделится при взаимодействии 3,6г магния с 0,4 г кислорода?
3. При увеличении температуры от 10 до 30°С скорость реакции, температурный коэффициент которой g =3…
1) возрастет в 3 раза; 3) уменьшится в 3 раза;
2) возрастет в 9 раз; 4) уменьшится в 9 раз.
Вариант 10
1.Какие реакции называют экзотермическими?
2.Дано термохимическое уравнение: 2 FeO + CO2 – 132 КДж. Сколько теплоты поглотится при взаимодействии 10,8 г оксида железа (II) и 1,08 г углерода?
3.Как повлияет на скорость химической реакции А + В = АВ увеличение концентрации вещества А в 3 раза?
Вариант 11
1.Какие реакции называют эндотермическими?
2.Во сколько раз следует увеличить давление в системе 2SO2 + O2 ® 2SO3, чтобы скорость прямой реакции возросла в 8 раз?
3.При увеличении давления химическое равновесие не смещается в системе:
1) СО (г) + CI2(г) ® СОCI2(г);
2) СО2(г) + С ® 2СО (г);
3) 2СО (г) + О2(г) ® 2СО2(г);
4) С + О2(г) ® СО2(г).
Дата добавления: 2015-09-11; просмотров: 1543;
