Тема 8 РАСТВОРЫ
Раствор является частным случаем дисперсной системы.
Истинные растворы – это термодинамически устойчивые системы переменного состава, состоящие из двух и более компонентов. В отличие от химических соединений, состав растворов может изменяться непрерывно (в определенных пределах).
Между частицами растворителя и растворенного вещества действуют физические и химические силы, обусловливающие образование растворов.
Вариант 1
1. Приведите общую классификацию растворов. Какими системами – гомогенными или гетерогенными – являются истинные растворы?
2. Что такое изотонический коэффициент и как он связан со степенью диссоциации электролита (для простейшего случая бинарных электролитов)?
3. Какова нормальность раствора едкого натра, если в 500 мл этого раствора содержится 2 грамма щелочи (МNaOH = 40)?
4. Напишите полное и сокращенное ионно-молекулярные уравнения реакции взаимодействия между хлоридом бария и сульфатом калия.
Вариант 2
1. Что называют осмотическим давлением раствора? Напишите уравнения, выражающие закон Вант – Гоффа:
а) для неэлектролитов P = RcT;
б) для электролитов p = iRcT.
2. Какие вещества в ионно-молекулярных уравнениях следует записывать в виде молекул, а какие – в виде ионов? Напишите полное и сокращенное ионно-молекулярные уравнения реакции взаимодействия между CaCO3 и азотной кислотой HNO3.
3. Сколько граммов вещества и воды надо взять для приготовления 500 г 2%-ного раствора?
4. Приведите схему ступенчатой диссоциации фосфорной кислоты.
Вариант 3
1. Как изменяются температуры кипения и температуры замерзания растворов по сравнению с чистым растворителем? Напишите математическое выражение закона Рауля:
а) для растворов неэлектролитов;
б) для растворов электролитов.
2. Какие электролиты называют сильными? Приведите формулы важнейших сильных и наиболее слабых ( 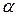 менее 2 %) кислот; сильных и слабого основания.
менее 2 %) кислот; сильных и слабого основания.
3. В литре раствора едкого натра и раствора калия содержится по 4 г щелочи. Нормальность какого из этих растворов больше? (MNaOH = 40, MKOH = 56).
4. Составьте полное и сокращенное ионно-молекулярные уравнения реакции взаимодействия между нитратом серебра и хлоридом железа (III).
Вариант 4
1. Что называют процентной (весовое) концентрацией раствора? Сколько надо отвесить граммов вещества, чтобы приготовить 300 г 5%-ного раствора?
2. Какие из кислот и оснований диссоциируют ступенчато? Приведите схему ступенчатой диссоциации ортомышьяковой кислоты.
3. Напишите формулы следующих кристаллогидратов:
а) гипса (дигидрат)
б) соды кристаллической (декагидрат)
4. Составьте сокращенное ионное уравнение реакций нейтрализации сильной кислоты сильным основанием.
Вариант 5
1. В чем сущность гидратной теории растворов Д. И. Менделеева? Какие известны экспериментальные доказательства этой теории?
2. Какие химические реакции в растворах доходят до конца, т. е. завершаются полным превращением исходных продуктов в конечные? Приведите примеры.
3. Сколько надо отвесить граммов едкого калии, чтобы приготовить 100 мл 0,5 н раствора (MKOH = 56)?
4. Напишите формулы (и заряд) ионов аммония, гидроксония, карбоната, дигидрофосфата, сульфида.
Вариант 6
1. Что представляет собой процесс осмоса?
2. В чем заключаются особенности диссоциации сильных электролитов? Что называют активностью ионов сильных электролитов и как связана эта величина с общей (аналитической) концентрацией?
3. В двух склянках содержатся растворы серной и ортофосфорной кислот. В литре каждого из них содержится по 49 г кислоты. Одинакова ли нормальность этих растворов? Ответ обоснуйте (MH 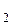 SO
SO 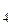 = 98, MH
= 98, MH 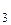 PO
PO 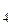 = 98).
= 98).
4. Приведите полное и сокращенное ионно-молекулярные уравнения реакции взаимодействия между нитратом (II) и гидроксидом аммония.
Вариант 7
1. Какой способ выражения концентрации растворов называют молярностью?
2. Какие вещества называют электролитами? Какой из классов неорганических соединений образует наибольшее число электролитов? Приведите примеры формул электролитов различных классов.
3. Напишите полное и сокращенное ионно-молекулярные уравнения реакции взаимодействия карбоната натрия и соляной кислоты.
4. Приведите схему ступенчатой диссоциации кремниевой кислоты.
Вариант 8
1. Как вычисляют эквиваленты оснований, кислот и солей в реакциях двойного обмена? Приведите пример кислоты, у которой молекулярная масса совпадает с эквивалентом, и пример соли, у которой эквивалент в три раза меньше молекулярной массы.
2. Приведите уравнение закона разбавления Оствальда для слабых электролитов. Какая величина точнее характеризует электролит – степень или константа диссоциации?
3. Сколько граммов сульфата цинка надо взять для приготовления одного литра 0,5 н раствора (MZnSO 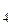 = 161, 4)?
= 161, 4)?
4. Приведите схему диссоциации фосфата аммония.
Вариант 9
1. Какой способ выражения концентрации растворов называют нормальностью? Сколько надо отвесить едкого натра, чтобы приготовить пять литров 0,1 н раствора (MNaOH = 40)?
2. Какого типа молекулы (по характеру химической связи) могут подвергаться электролитической диссоциации? Какого типа растворители могут вызывать процесс ионизации?
3. Напишите полное ионно-молекулярное уравнение реакции образования нерастворимого в воде гидрофосфата кальция в результате взаимодействия соответствующего основания и кислоты.
4. Приведите схему диссоциации гидроксида алюминия по основному и кислотному
типам.
Вариант 10
1. Какой способ выражения концентрации растворов называют титром?
2. Сформулируйте основные положения теории электролитической диссоциации.
3. Сколько граммов сульфата алюминия надо взять для приготовления двух литров 0,1 н раствора? (MAl 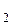 (SO
(SO 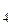 )
) 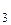 = 342).
= 342).
4. Приведите схему ступенчатой диссоциации ортофосфорной кислоты.
Вариант 11
1. Какие растворы называют ненасыщенными и перенасыщенными? Какие из них являются малоустойчивыми?
2. Что представляет собой константа диссоциации слабого электролита? Напишите выражение константы для уксусной кислоты и гидроксида аммония.
3. Сколько граммов гидроксида кальция надо взять, чтобы приготовить 1 литр 0,01 н раствора? (MCa (OH) 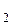 = 72).
= 72).
4. Напишите схему ступенчатой диссоциации угольной кислоты.
Вариант 12
1. Какой способ выражения концентрации растворов называют молярностью? Сколько граммов хлорида кальция надо взять для приготовления 500 мл 2 М раствора? (MCaCl 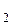 = 111).
= 111).
2. В чем особенности диссоциации амфотерных гидроксидов? Приведите полную схему диссоциации гидроксида цинка.
3. Напишите формулы (и заряды) сложного катиона и двух сложных анионов и укажите их названия.
4. Составьте полное и сокращенное ионно-молекулярные уравнения реакции нейтрализации ортофосфорной кислоты едким натром.
Вариант 13
1. Какие системы называют истинными растворами?
2. Что представляет собой процесс электрической диссоциации? Нарисуйте схему диссоциации хлорида калия, показав роль растворителя.
3. Определите нормальность раствора серной кислоты, в двух литрах которого содержится 49 г кислоты (М = 98).
4. Напишите полное и сокращенное ионно-молекулярные уравнения реакции взаимодействия между нитратом бария и сульфатом аммония.
Вариант 14
1. Что является мерой растворимости вещества при данных условиях?
2. Что называют степенью диссоциации электролита? От каких факторов зависит величина степени диссоциации и какие значения она может принимать?
3. Сколько граммов поташа надо взять, чтобы приготовить 200 мл 0,5 н раствора?
(М = 138).
4. Напишите схему электролитической диссоциации молекул сульфата железа (III) и аммиачной селитры. Сложные ионы подчеркните.
Дата добавления: 2015-09-11; просмотров: 971;
