Тема 11 КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Строение координационной сферы комплексных соединений: центральный ион – комплексообразователь, лиганды, донорные атомы лигандов, координационное число, геометрия координационной сферы, внешняя сфера.
Поведение комплексных соединений в водных растворах. Константы устойчивости и константы неустойчивости. Факторы, влияющие на устойчивость комплексных соединений в растворах: температура, хелатный и макроциклический эффекты, заряд центрального иона – комплексообразователя и его радиус.
Теория координационной химической связи: метод валентных связей, теория кристаллического поля. Цвет комплексных соединений и кинетическая подвижность лигандов в координационной сфере.
Значение в биохимии клетки комплексных соединений как активных центров ферментов.
Вариант 1
1. Проанализируйте комплексные соединения
K 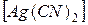 и
и 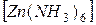 (OH)2.
(OH)2.
2. Доведите до конца уравнение реакции комплексообразования
2KCl + PtCl4 
3. Напишите уравнение реакции двойного обмена:
(NH4)2 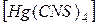 + CoCl2
+ CoCl2 
Вариант 2
1. Проанализируйте комплексные соединения
K2 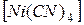 и
и 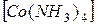 Cl2.
Cl2.
2. Доведите до конца уравнение реакции комплексообразования
ZnCl2 + 4NH3 
3. Напишите уравнение реакции двойного обмена:
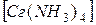 SO4 + BaCl2
SO4 + BaCl2 
Вариант 3
1. Проанализируйте комплексные соединения
(NH4)2 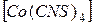 и
и 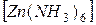 SO4
SO4
2. Доведите до конца уравнение реакции комплексообразования
4KCN + Fe (CN)2 
3. Напишите уравнение реакции двойного обмена:
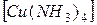 SO4 + Ba (NO3)2
SO4 + Ba (NO3)2 
Вариант 4
1. Проанализируйте комплексные соединения
K2 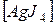 и
и 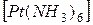 Cl2.
Cl2.
2. Доведите до конца уравнение реакции комплексообразования
CuSO4 + 4NH3 
3. Напишите уравнение реакции двойного обмена:
K4 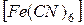 + FeSO4
+ FeSO4 
Вариант 5
1. Проанализируйте комплексные соединения
K4 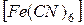 и
и 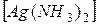 Cl.
Cl.
2. Доведите до конца уравнение реакции комплексообразования
NaCl + AuCl3 
3. Напишите уравнение реакции двойного обмена:
Na 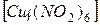 + KCl
+ KCl 
Вариант 6
1. Проанализируйте комплексные соединения
(NH4)2 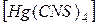 и
и 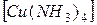 SO4.
SO4.
2. Доведите до конца уравнение реакции комплексообразования
AgCl + 2NH3 
3. Напишите уравнение реакции двойного обмена:
K4 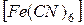 + FeCl2
+ FeCl2
Вариант 7
1. Проанализируйте комплексные соединения
K3 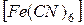 и
и 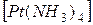 Cl2.
Cl2.
2. Доведите до конца уравнение реакции комплексообразования
CuSO4 + 4NH3 
3. Напишите уравнение реакции двойного обмена:
Na3 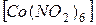 + KCl
+ KCl 
Вариант 8
1. Проанализируйте комплексные соединения
K 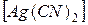 и
и 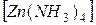 Cl2.
Cl2.
2. Доведите до конца уравнение реакции комплексообразования
3KCN + Fe (CN)3 
3. Напишите уравнение реакции двойного обмена:
(NH4)2 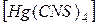 + CoCl2
+ CoCl2 
Вариант 9
1. Проанализируйте комплексные соединения
K3 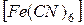 и
и 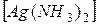 Cl.
Cl.
2. Доведите до конца уравнение реакции комплексообразования
NaCl + AuCl3 
3. Напишите уравнение реакции двойного обмена:
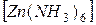 SO4 + Ba (NO3)2
SO4 + Ba (NO3)2 
Вариант 10
1. Проанализируйте комплексные соединения
K4 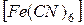 и
и 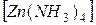 SO4.
SO4.
2. Доведите до конца уравнение реакции комплексообразования
3NaNO2 + Co (NO2)3 
3. Напишите уравнение реакции двойного обмена:
K3 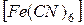 + Fe (NO3)3
+ Fe (NO3)3 
Вариант 11
1. Проанализируйте комплексные соединения
Na 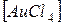 и
и 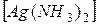 Cl.
Cl.
2. Доведите до конца уравнение реакции комплексообразования
2KCl + PtCl4 
3. Напишите уравнение реакции двойного обмена:
Na3 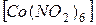 + K2SO4
+ K2SO4 
Вариант 12
1. Проанализируйте комплексные соединения
K3 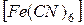 и
и 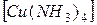 .
.
2. Доведите до конца уравнение реакции комплексообразования
2KJ + HgJ2 
3. Напишите уравнение реакции двойного обмена:
K4 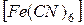 + Fe2(SO4)2
+ Fe2(SO4)2 
Вариант 13
1. Проанализируйте комплексные соединения
Na3 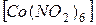 и
и 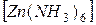 (OH)2.
(OH)2.
2. Доведите до конца уравнение реакции комплексообразования
PtCl2 + 4NH3 
3. Напишите уравнение реакции двойного обмена:
K3 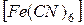 + FeCl2
+ FeCl2 
Вариант 14
1. Проанализируйте комплексные соединения
K2 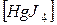 и
и 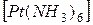 Cl2.
Cl2.
2. Доведите до конца уравнение реакции комплексообразования
AgCl + 2NH3 
3. Напишите уравнение реакции двойного обмена:
K4 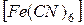 + Fe (NO3)3
+ Fe (NO3)3 
СОДЕРЖАНИЕ
Тема 1 ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ......................................... 3
Тема 2 СТРОЕНИЕ АТОМА........................................................................................ 6
Тема 3 ХИМИЧЕСКАЯ СВЯЗЬ.................................................................................. 9
Тема 4 ОКСИДЫ И КИСЛОТЫ............................................................................... 12
Тема 5 ОСНОВАНИЯ, СОЛИ.................................................................................... 15
Тема 6 ОСНОВНЫЕ ЗАКОНЫ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ: ТЕПЛОВЫЕ ЭФФЕКТЫ, СКОРОСТЬ РЕАКЦИИ,
ХИМИЧЕСКОЕ РАВНОВЕСИЕ................................................................. 18
Тема 7 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ............. 20
Тема 8 РАСТВОРЫ..................................................................................................... 24
Тема 9 ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ............................................. 27
Тема 10 АЗОТ, ФОСФОР, СЕРА.............................................................................. 29
Тема 11 КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ.......................................................... 32
Дата добавления: 2015-09-11; просмотров: 1246;
