Тема 3 ХИМИЧЕСКАЯ СВЯЗЬ
Природа химической связи. Квантово-механическая трактовка механизма образования химической связи.
Типы связей: ковалентная, ионная, координационная (донорно-акцепторная), металлическая, водородная.
Характеристики связи: энергия и длина связи, направленность, насыщенность, электрические дипольные моменты, эффективные заряды атомов, степень ионности.
Метод валентных связей (ВС). Сигма- и пи-связи. Типы гибридизации атомных орбиталей и геометрия молекул. Неподеленные электронные пары молекул.
Метод молекулярных орбиталей (МО) и особенности использованной в нем волновой функции. Связывающие и разрыхляющие молекулярные орбитали. Принципы заполнения их электронами, порядок и энергия связей. Связи в двухатомных гомоядерных молекулах.
Свойства химических связей в твердом состоянии вещества. Свойства ионных кристаллов. Металлическая связь и строение металлических кристаллов. Специфические свойства металлов. Молекулярные кристаллы и их свойства.
Применение теории химической связи в химии и биологии. Энергия ковалентных связей и энергетика химических реакций. Предсказание геометрии молекул. Гибкость биомолекул как результат свободного вращения вокруг s-связей. Взаимодействие биомолекул с водой как следствие образования водородных связей и взаимодействия диполей воды с атомами, имеющими значительные заряды.
Вариант 1
1. Какую связь называют ионной? Покажите механизм возникновения ионной связи на примере образования фторида калия. Можно ли говорить о молекуле CI для твердого состояния вещества?
2. В каких молекулах из перечисленных ниже имеется p-связь? CH4; N2; BeCl2; CO2. Ответ подтвердите графическими формулами.
3. Каков механизм переменной валентности элементов? Почему сера проявляет переменную валентность, кислород всегда не более чем двухвалентен?
4. Обозначьте тип гибридизации орбиталей в молекулах CH4, MgCl2, BF3.
Вариант 2
1. В чем заключается особенность типично ковалентной связи? Покажите механизм возникновения этой связи в обобщенно-схематическом виде.
2. Из числа перечисленных ниже соединений выпишите двумя столбцами молекулы с одинарной и кратной связью. Те, в которых имеются π-связь, подчеркните.
C2H4, NH3, N2, CCl4, SO2, H2O.
3. Как влияет характер химической связи атомов на свойства веществ (способность к диссоциации, t и т. д.)?
4. Изобразите рисунком процесс Sp2-гибридизации. Приведите пример соответствующей молекулы и укажите ее геометрию.
Вариант 3
1. Как изменяется запас энергии молекул по сравнению с запасом энергии разрозненных атомов? Какая молекула прочнее: H2(ECB = 431,8 кДж) или N2(ECB = 945 кДж)?
2. Чем определяется величина ковалентности элемента? Приведите графические формулы молекул N2, NH3, NO и определите в каждой из них ковалентность азота.
3. Что называют гибридизацией орбиталей? Нарисуйте одну гибридную орбиталь и объясните, почему гибридные связи образуют более прочную связь, чем негибридные.
4. Дайте общую характеристику кристаллических веществ и назовите типы кристаллических решеток.
Вариант 4
1. Перечислите основные виды химических связей и приведите по одному примеру соответствующих этим видам связи химических соединений.
2. Изобразите рисунками два возможных способа перекрывания р-электронных облаков.
3. Что называют длиной диполя и дипольным моментом молекулы? От чего зависит величина дипольного момента?
4. Из перечисленных ниже молекул выпишите те, в которых имеются Sp-гибридные орбитали, и укажите их геометрию.
BeCl2, BCl3, H2O, C2H2.
Вариант 5
1. В чем особенность донорно-акцепторной связи? Покажите ее механизм в обобщенно-схематической форме и на примере.
2. От чего зависит величина ковалентности атома в молекуле? Имеет ли ковалентность знак? Определите ковалентность серы в молекуле H2S и ионе 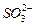 по их графическим формулам.
по их графическим формулам.
3. Сколько σ- и π-связей в молекуле N+, ионе 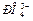 ?
?
4. Почему молекула CaCl2 (в парах) имеет линейную форму, молекула BCl3 треугольную – плоскую, а молекула CCl4 – тетраэдрическую?
Вариант 6
1. Какова физическая природа типично ковалентной связи в соответствии с представлениями волновой механики? Какими должны быть спины электронов взаимодействующих атомов, чтобы они могли вступить друг с другом в химическое взаимодействие?
2. Как современная теория химической связи объясняет переменную валентность элементов? Приведите пример.
3. Объясните с помощью графических формул? почему при наличии полярных связей в молекулах CO2 и SO2 одна из них неполярна, а другая полярна.
4. Выпишите химические соединения, в образовании которых участвуют Sp2-гибридные орбитали C2H4; CH4; BCl3; C2H2.
Вариант 7
1. В каких случаях и как возникает водородная связь? Приведите примеры.
2. Выпишите те из приведенных ниже молекул, в которых имеется типично-ковалентная связь между атомами PCl3; N2; K2S; SO3. Приведите их графические формулы.
3. Каким принципам и правилам подчиняется заполнение и атомных, и молекулярных орбиталей? Как определяется число химических связей в молекуле по методу МО?
4. Какие из перечисленных молекул имеют угловую форму? CO2, SO2, H2O.
Вариант 8
1. В чем заключаются особенности металлической связи?
2. Сколько холостых электронов у атомов Al и Sе в основном состоянии? Какой процесс обусловливает возможность повышения ковалентности этих элементов до величины, соответствующей номеру их группы в системе Д. И. Менделеева?
3. В каких из приведенных молекул абсолютное значение, степени окисления и ковалентность подчеркнутых элементов не совпадают?
N2, H2, NH3, C2H2.
Ответ обоснуйте графическими формулами.
4. Изобразите схематически процесс Sp3-гибридизации орбиталей. Приведите примермолекулы, в которой осуществляется этот тип гибридизации.
Вариант 9
1. Для каких из перечисленных ниже молекул возможны межмолекулярные водородные связи и почему? СаН2, Н2О, HF2, CH4.
2. От чего зависит степень поляризации связи между атомами в молекуле и что является ее количественной характеристикой?
3. Сколько σ- и π-связей в молекуле СО2? Какой здесь тип гибридизации орбиталей атома углерода?
4. Какие из перечисленных веществ имеют в твердом состоянии молекулярные, а какие – ионные кристаллические решетки?
NaJ, H2O, K2SO4, CO2, J2.
Вариант 10
1. Изобразите по методу валентных схем (ВС) строение молекул Н2, N2 и NH3. Каков тип связи между атомами этих молекул? В какой из молекул имеются π-связи?
2. По типу химической связи определите, у какого из перечисленных ниже веществ а) наибольшая способность к диссоциации; б) самая низкая температура плавления; в) самая высокая температура кипения. HF; Cl2.
3. В чем заключается направленность ковалентной связи? Покажите на примере строения молекулы воды, как влияет направленность связи на геометрию молекулы.
4. В каких из перечисленных молекул углы связи между атомами равны 180°?. Какой тип гибридизации орбиталей это объясняет?
CH4, BF3, MgCl2, C2H2.
Вариант 11
1. Какие электроны: спаренные или холостые – определяют возможное число типично-ковалентных связей атома в данном энергетическом состоянии? В качестве примера рассмотрите атом серы.
2. Чем отличаются друг от друга σ- и π-связи? Могут ли гибридные орбитали образовывать π-связь? Сравните прочность π- и σ-связей.
3. Изобразите рисунком схему Sр-гибридизации орбиталей и выпишите те из приведенных молекул, в которых имеется этот тип гибридизации.
BeCl2, CH4, AlF3, C2H2.
4. Дайте общую характеристику особенностей аморфных тел.
Вариант 12
1. Чем отличаются ковалентно-неполярная и ковалентно-полярная связь? Объясните на примерах, в каких случаях они возникают.
2. Укажите типы связей в следующих соединениях и ионах:
CsF, [Cu (NH3)4]2+, Cl2, SO3.
3. Сколько гибридных орбиталей образуется при Sр3-гибридизации? Какова геометрия молекулы СН4, в которой этот тип гибридизации осуществляется?
4. Какие известны типы межмолекулярных взаимодействий?
Вариант 13
1. По величинам электроотрицательности атомов серы, хлора и натрия определите, какие из них образуют друг с другом ионную, а какие – ковалентную связь.
2. Перечертите таблицу и заполните ее для подчеркнутых атомов.
| Состав молекулы | Ковалентность | Степень окисления |
| N2 | ||
| NH3 | ||
| C2H4 |
3. Почему фосфор может образовывать соединения PCl3 и PCl5, а азот – только NCl3? К какому атому смещена во всех этих молекулах электронная пара?
4. Какие из перечисленных молекул имеют форму тетраэдра и почему?
Вариант 14
1. Чем определяется величина электровалентности элемента в ионных соединениях? Обозначьте электровалентность в соединениях K2S, MgCl2, AlCl3. Совпадает ли она со степенью окисления?
2. Чем отличается метод молекулярных орбиталей (МО) от метода валентных связей (ВС)? Приведите схемы образования молекулы водорода по методу ВС и методу МО.
3. Какие типы связей имеются в молекуле NH4Cl? Покажите их на электронной схеме строения молекулы.
4. Укажите типы гибридизации орбиталей и геометрию молекул BeF2, СH4, BCl3.
Дата добавления: 2015-09-11; просмотров: 2333;
