АМИНОКИСЛОТЫ И ИХ НЕКОТОРЫЕ ФУНКЦИИ В ОРГАНИЗМЕ
Общее число встречающихся в природе аминокислот достигает около 300. Среди них различают: а) аминокислоты, входящие в состав белков; б) аминокислоты, образующиеся из других аминокислот, но только после включения последних в процесс синтеза белка (их обнаруживают
в гидролизатах белков); в) свободные аминокислоты. С точки зрения питания выделяют эссенциальные (незаменимые) аминокислоты. Эти аминокислоты не могут синтезироваться в организме человека и должны поступать с пищей.
Аминокислоты - полифункциональные соединения, содержащие по меньшей мере две разные химические группировки, способные реагировать друг с другом с образованием ковалентной пептидной (амидной) связи:
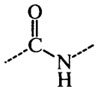
В аминокислотах амино- (-NH2) и карбоксильная (-СООН) группы присоединены к одному и тому же атому углерода, который называют а-углеродом. Природа боковых цепей 20 протеиногенных аминокислот приведена на рис. 2.4.
Для объяснения и понимания свойств аминокислот следует помнить следующее.
1. Аминокислоты, существуя в твердом или растворенном состоянии, всегда находятся в форме биполярных ионов (цвиттерионов), положение равновесия которых зависит от рН среды:
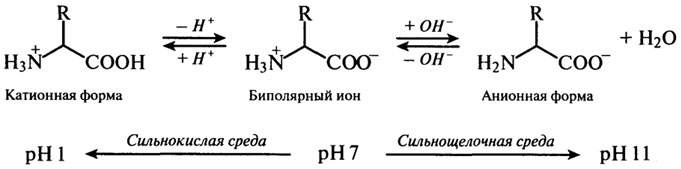
Нахождение аминокислот в виде ионов обуславливает растворимость в воде и нерастворимость в неполярных жидкостях. Большинство аминокислот растворимы в воде, но у аминокислот с гидрофобными группами (изолейцин, лейцин, тирозин) растворимость относительно невысока. В организме ионное состояние аминокислот определяет их всасываемость в желудочно-кишечном тракте после гидролитического расщепления белков и транспорт к различным органам и тканям. Способность к ионизации в кислой или щелочной среде лежит в основе разделения аминокислот ионообменной хроматографией и электрофорезом.
А. Гидрофобные аминокислоты (с неполярными радикалами):
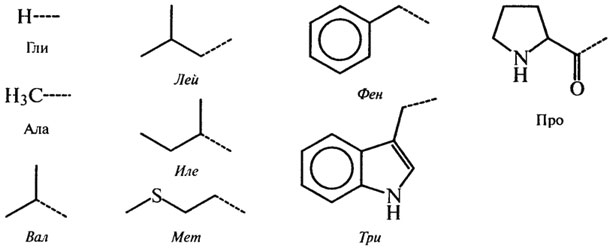
Б. Полярные аминокислоты
Б1. С гидрофильными радикалами (неионогенные):
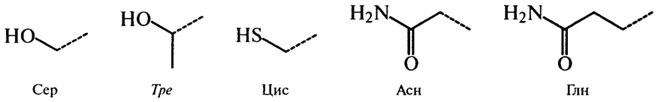
Б2. Кислые (ионогенные):
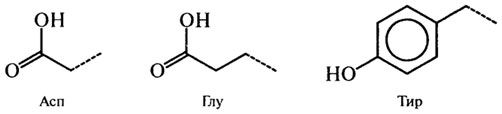
Б3. Основные (ионогенные):
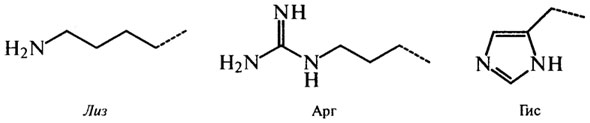
Рис. 2.4.Боковые цепи аминокислот, входящих или способных включаться в состав белков (курсивом выделены названия незаменимых аминокислот)
2. Большинство природных а-аминокислот относятся к L-стереохи-мическому ряду, однако в некоторых пептидах (антибиотики грамицидин, актиномицин) встречаются аминокислоты D-ряда. Последние, как правило, не усваиваются организмом человека. Аминокислоты D- и L-рядов значительно отличаются по вкусу. Так, D-глутаминовая кислота не имеет вкуса, а L-глутаминовая кислота обладает вкусом мяса. Получая
последнюю из клейковины пшеницы, ее используют в качестве вкусовой добавки к пищевым концентратам. Сладкий вкус имеют и другие аминокислоты L-ряда: валин, треонин, пролин, серии и т. д. Они все в большей степени привлекают к себе внимание как заменители сахара в питании диабетиков.
3. Аминокислоты отличаются друг от друга структурой боковых цепей, от которой зависят химические, физические свойства и физиологические функции белков в организме. Аминокислоты с гидрофобными боковыми группами большей частью локализованы внутри белковых макромолекул, тогда как аминокислоты с полярными боковыми группами располагаются на их поверхности. В составе полярных а-аминокислот имеются функциональные группы, способные к ионизации (ионогенные) и не способные переходить в ионное состояние (неионогенные). При этом кислые и основные ионогенные группы радикалов, как правило, располагаясь на поверхности молекул белков, принимают участие в ионных (электростатических) взаимодействиях. В роли полярных неионогенных групп в молекулах белков выступают гидроксильные группы серина, треонина и амидные группы глутамина (Глн) и аспарагина (Асн). Эти группы могут располагаться как на поверхности, так и внутри белковой молекулы, и принимать участие в образовании водородных связей с другими полярными группировками.
Почти все а-аминокислоты, поступающие из пищеварительного тракта человека в кровяное русло организма, претерпевают ряд общих превращений, назначение которых заключается в обеспечении пластическим материалом процесса синтеза белков и пептидов и осуществлении дыхания с образованием АТФ (рис. 2.5). В основе таких превращений
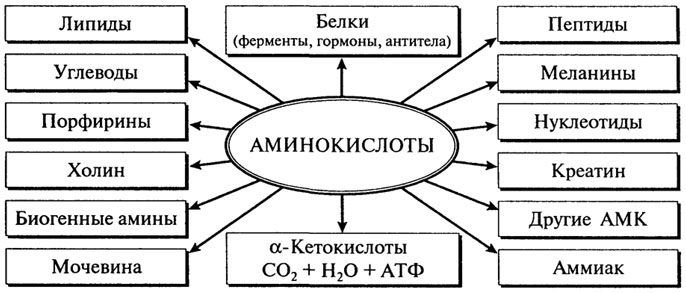
Рис.2.5. Основные функции аминокислот в организме
лежат реакции дезаминирования, трансаминирования и декарбоксили-рования. Эти реакции подробно рассматриваются в курсе биохимии, здесь же остановимся на специфических путях обмена и модификации отдельных а-аминокислот.
В тканях организма легко осуществляется ферментативная окислительно-восстановительная реакция, обусловленная наличием в цистеи-не реакционноспособной SH-группы:
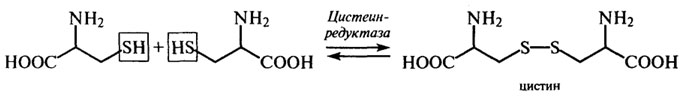
Свойство данной аминокислоты окисляться придает ей защитные и радиопротекторные свойства. В присутствии цистеина снижается интенсивность окислительных процессов в липидах и белках, повышается устойчивость организма к ионизирующим излучениям и стабилизируется качество принимаемых лекарственных препаратов. При участии двух остатков цистеина в полипептидных цепях образуются дисульфидные связи, которые обуславливают биологическую активность или функциональные свойства белков в составе пищи. Особо важную роль дисульфидные связи играют в белках пшеницы, так как они придают клейковине упругие свойства (см. Белки злаков).
Основная физиологическая роль другой серосодержащей аминокислоты - метионина - связана с наличием лабильной метальной группы. Отдавая группу - СН3 через образование S-аденозилметионина, метио-нин принимает участие в синтезе глицерофосфолипидов:
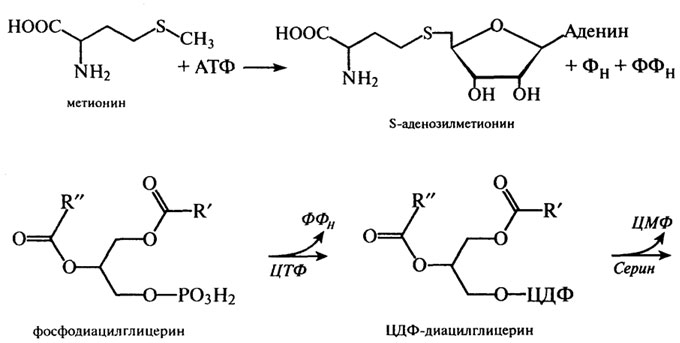
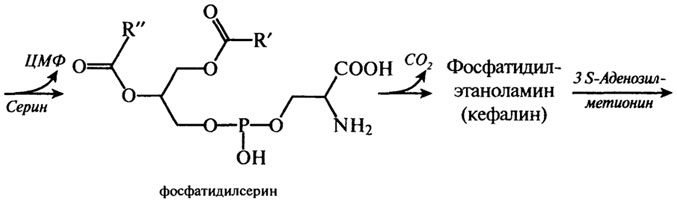
В приведенных реакциях синтеза глицерофосфолипидов видна физиологическая роль и аминокислоты серии, которая, как и треонин, в этерифицированном виде при участии фосфорной кислоты в большом количестве входит в состав сложных белков - фосфопротеидов (казеина молока и вителлина яйца):
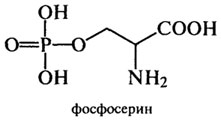
Серии в свою очередь синтезируется из глицина под действием фермента, содержащего тетрагидрофолевую кислоту (ТГФК). Эта реакция изучена с помощью метода меченых атомов:
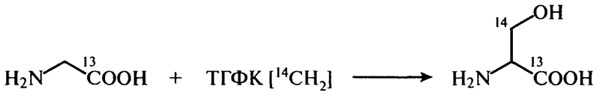
Глицин является предшественником пуринового кольца тема крови и образует так называемые парные соединения. С желчными кислотами, например холевой кислотой, он образует гликохолевую кислоту, с бензойной кислотой - гиппуровую кислоту:
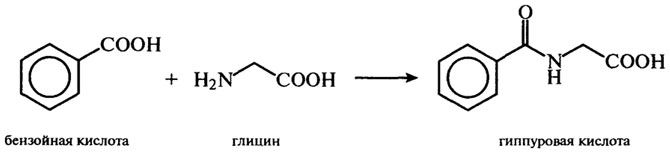
Гликохолевая кислота принимает участие в процессе усвоения липи-дов, а в форме гиппуровой кислоты из организма выводится токсичная бензойная кислота.
Три аминокислоты - аргинин, глицин и метионин - участвуют в синтезе креатина - соединения, с помощью которого в мышечной ткани происходит непрерывный ресинтез макроэрга АТФ:
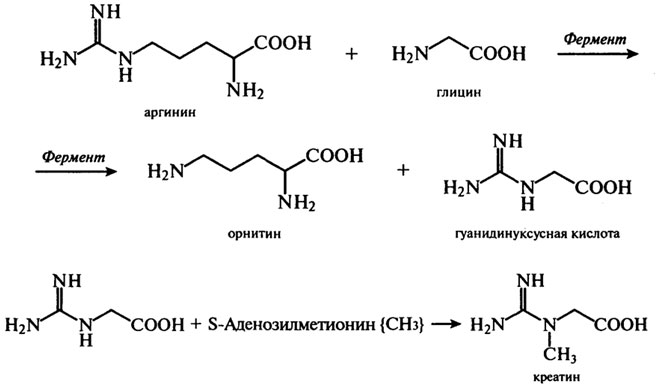
При участии креатина в организме человека и животных образуется креатинфосфат, который по мере необходимости отдает свою фосфатную группу молекулам АДФ, превращаясь в креатинин:
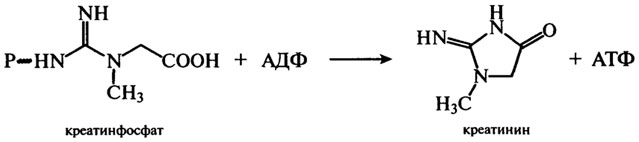
Креатин и циклический креатинин входят в состав мясного экстракта, их соотношение зависит от рН среды и температуры. Так, при нагревании мяса в кислой среде в экстракте преобладает креатинин.
В составе живых организмов, пищевых продуктов и сырья встречаются и другие, так называемые "редкие", аминокислоты, не входящие в
состав белков. Так, β-аланин является составной частью мясных бульонов, а бетаин - мелассы - отхода свеклосахарного производства:

Аминокислоты цитруллин и орнитин участвуют вместе с аргинином в цикле образования мочевины у человека и животных. Фундаментальную роль в обмене веществ живых организмов играют глутаминовая и аспарагиновая кислоты. Они участвуют в процессах расщепления, синтеза и переноса, часто в форме амидов:
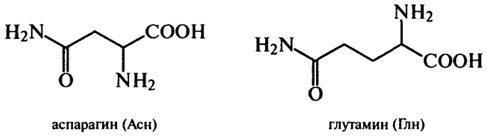
Глутамин, например, является основной формой переноса аммиака в крови человека и вместе с аспарагиновой кислотой служит предшественником пиримидинового кольца нуклеотидов. Азот 1 происходит из аспарагиновой кислоты, азот 3 - из глутамина, углерод 4, 5, 6 кольцу отдает аспарагиновая кислота, а углерод 2 происходит от СО2. Предварительно молекула СО2 и амидная группа глутамина образуют карбамоилфосфат:
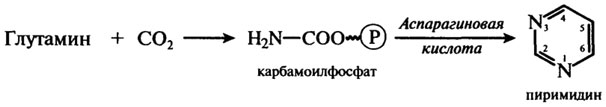
Реакции декарбоксилирования глутаминовой кислоты с образованием γ-аминомасляной кислоты, относящейся к группе медиаторов, отводится важная роль в обмене веществ мозга и нервной ткани.
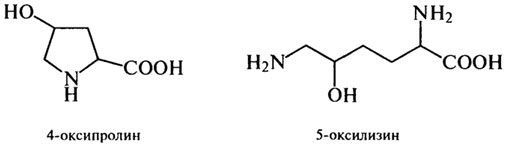
С обменом глутаминовой кислоты тесно связан обмен пролина, который синтезируется из нее в результате восстановления пролиндегид-рогеназой. Пролин играет важную роль при формировании структуры коллагена и белков пшеничной клейковины, вызывая изгибы в полипептидных цепях. В фибриллярных белках соединительной ткани мяса
и коллагене, наряду с пролином, встречаются 4-оксипролин и 5-окси-лизин, образующиеся за счет окисления соответствующих аминокислот уже после включения в белок. Присутствие оксипролина в мясных и колбасных изделиях оказывает влияние на их качество и учитывается при его оценке.
Тирозин является ответственным за окраску волос, кожи, глаз, за темный цвет пищевых продуктов (например, ржаного хлеба), так как с его участием синтезируются темноокрашенные пигменты - меланины. Механизм реакции до конца не изучен, но известны первые этапы их синтеза. Под действием медьсодержащего фермента тирозин превращается в диоксифенилаланин (ДОФА), который далее окисляется, циклизуется, образуя индолхинон. Полимеризация последнего приводит к синтезу меланинов:
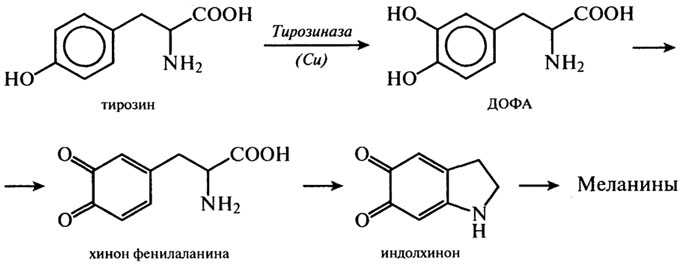
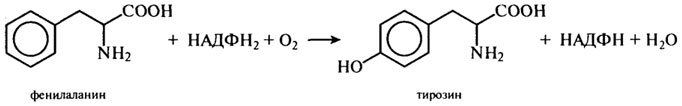
Образование меланинов усиливается под влиянием ультрафиолетовых лучей (при загаре) и может быть причиной злокачественных новообразований. При наследственном заболевании - альбинизме, характеризующемся отсутствием фермента тирозиназы, наоборот, не наблюдается пигментации кожи, волос, но присутствует боязнь света. Сам же тирозин образуется из фенилаланина. В здоровом организме реакция синтеза тирозина протекает с участием двухкомпонентного фермента фенилала-нингидроксилазы по схеме:
При наследственном заболевании фенилкетонурией у человека происходит мутация гена, который кодирует синтез одного из компонентов фермента, содержащего в качестве переносчика водорода соединение биоптерин. Наследственная аномалия, сопровождающаяся тяжелой умственной отсталостью, характеризуется превращением фенилаланина не по указанному выше пути, а по типу переаминирования с избыточным накоплением фенилпировиноградной кислоты в моче:
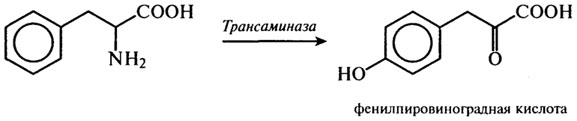
Снизить степень умственной отсталости, особенно у детей в раннем возрасте, можно с помощью понижения содержания фенилаланина в пище, чтобы избыток последнего не оказывал токсического действия на клетки головного мозга. Известен и ряд других врожденных заболеваний, связанных с нарушением обмена аминокислот. Так, алкаптонурия возникает в результате недостатка оксидазы гомогентизиновой кислоты - продукта обмена тирозина, гиперпролинемия - из-за недостатка фермента пролиноксидазы, а цитруллинемия обусловлена нарушением цикла образования мочевины, так как в организме не синтезируется аргинин-сукцинатсинтетаза.
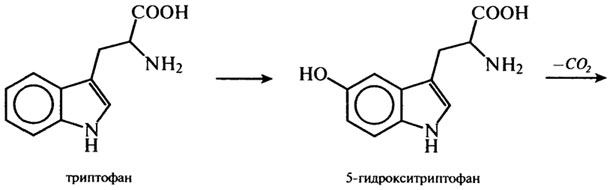
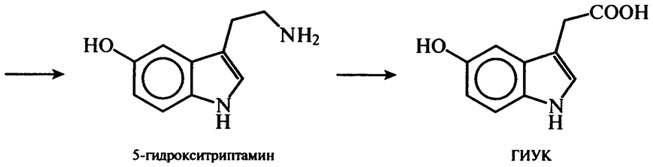
Незаменимая аминокислота триптофан служит предшественником никотиновой кислоты, НАД и НАДФ, серотонина и индолилуксусной кислоты - гормона роста растений. Серотонин, обладая сосудосуживающим действием, синтезируется в клетках кишечника и нервной ткани. Из организма он выводится в виде гидрооксииндолилуксусной кислоты (ГИУК):
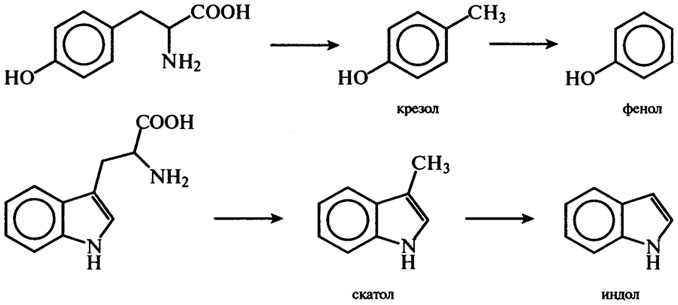
Из тирозина и триптофана, содержащихся в пище, при участии микробных ферментов в кишечнике образуются ядовитые продукты - крезол, фенол, скатол, индол, обезвреживание которых происходит в печени путем связывания с серной или глюкуроновой кислотой с образованием нетоксичных (парных) кислот, например фенолсерной кислоты.
В результате декарбоксилирования аминокислот в организме образуются некоторые важные биогенные амины. Образование и роль этанола-мина, серотонина и γ-аминомасляной кислоты уже рассмотрено. Здесь же отметим, что декарбоксилирование аспарагиновой кислоты обеспечивает синтез р-аланина, являющегося составной частью биологически активных соединений - КоА и АПБ, а декарбоксилирование лизина и орнитина под влиянием ферментов кишечной микрофлоры приводит к образованию ядовитых диаминов - кадаверина и путресцина. В здоровом организме оба амина полностью обезвреживаются в слизистой оболочке кишечника.
Часть аминокислот выполняет роль медиаторов - веществ, принимающих участие в передаче нервных импульсов от одной нервной клетки к другой. При раздражении нервных волокон медиаторы реагируют со специфическим рецептором и обеспечивают соответствующую физиологическую функцию: регуляцию сна, бодрствования, сердечно-сосудистой деятельности, терморегуляцию тела. К медиаторам относятся
ацетилхолин, глутаминовая и аспарагиновая кислота, глицин, ГАМК, ги-стамин, серотонин, норадреналин.
Таким образом, приведенные сведения показывают, какую большую роль играют аминокислоты в синтезе важнейших физиологически активных соединений в организме и обеспечении некоторых свойств пищевого сырья и продуктов. Обобщенная схема представлена на рис. 2.6.
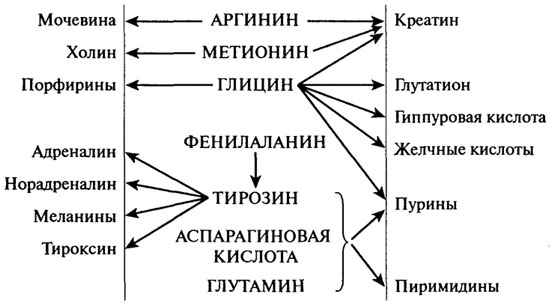
Рис. 2.6.Роль аминокислот
28 :: 29 :: 30 :: 31 :: 32 :: 33 :: 34 :: 35 :: 36 :: 37 :: 38 :: 39 :: Содержание
39 :: 40 :: 41 :: 42 :: 43 :: 44 :: Содержание
Дата добавления: 2015-11-18; просмотров: 3614;
