Примеры индивидуальных заданий для промежуточного контроля
Тест «Строение атома»
1. На энергетической диаграмме распределения электронов в основном состоянии атома
| 4p | ↑ | ↓ | ↓ | |||||||||
| 4s | ↑↓ |
а) нарушений нет
б) нарушен принцип минимума энергии
в) нарушено правило Хунда
г) нарушен принцип Паули
2. Установите соответствие между квантовым числом и его характеристикой:
| а) главное квантовое число | 1) вращательный момент количества движения ẽ |
| б) орбитальное квантовое число | 2) форма электронного облака |
| в) магнитное квантовое число | 3) размер электронного облака |
| г) спиновое число | 4) ориентация электронного облака в пространстве |
3. Число вакантных орбиталей на внешнем р-подуровне атома бора равно:
а) 0
б) 1
в) 2
г) 3
4. Определите значение квантовых чисел для электрона на 4f-подуровне:
| ↑ | ↑ | ↑ | ↑ | ↑ | ↑ |
а) n=4 l=0 m=6 s=1/2 в) n=4 l=3 m=2 s=1/2
б) n=4 l=1 m=2 s=1/2 г) n=4 l=3 m=-2 s=1/2
5. Какие АО будут заполняться первыми: 6p или 7s; 5d или 7p?
а) 6p и 5d
б) 7s и 5d
в) 6p и 7p
г) 7s и 7p
6. Электронная конфигурация иона Mg+2 имеет вид:
а) 1s22s22p6
б) 1s22s22p63s2
в) 1s22s22p63s23p2
г) 1s21p62s2
7. Максимальное количество электронов на p- и f- подуровнях:
а) 3 и 7
б) 10 и 2
в) 6 и 14
г) 14 и 6
8. Электронную конфигурацию 4s23d5 имеет атом ____ в основном состоянии:
а) марганца
б) хрома
в) железа
г) магния
9. Укажите графическую формулу внешнего уровня иона S2–:
| а) | ↑↓ | ↑↓ | ↓ | ↓ | в) | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
| б) | ↑↓ | ↓ | ↓ | ↓ | ↓ | г) | ↓ | ↓ | ↓ | ↓ | ↓ | ↓ | ↓ | ↓ |
10. Суммарный спин электронов атома с электронной конфигурацией …5d66s2 в основном состоянии равен:
а) 0
б) 1
в) 2
г) 4
Тест «Периодический закон и периодическая система элементов»
1. Тип гибридизации атомных орбиталей углерода в молекуле СCl4
а) sp
б) sp2
в) sp3
г) нет гибридизации
2. Для какого типа гибридизации характерен валентный угол 120о?
а) sp
б) sp2
в) sp3
г) s2p2
3. В каком ряду соединений все связи ковалентные полярные?
а) CaCl2, HF, Fe
б H2, CO2, H2SO4
в) Na2O, S8, NH3
г) H2O2, H2O, HCl
4. Ионная связь характерна для соединения
а) Н2SO4
б) СuSO4
в) Cu
г) СС14
5. Между молекулами какого вещества возникают водородные связи?
а) HI
б) HF
в) H2S
г) H2Te
6. Длина связи наибольшая в соединении
а) HF
б) HCl
в) HBr
г) HI
7. В каком соединении энергия связи наименьшая?
а) AsH3
б) PH3
в) SbH3
г) NH3
8. Расположите соединения в порядке увеличения полярности связи
а) H2O
б) CН4
в) HF
г) NH3
9. В молекуле СО имеются
а) σ-связи
б) π-связи
в) одна σ- и одна π-связь
г) одна σ- и две π-связи
10. Число двойных связей одинаково в соединениях:
а) N2, C2H2
б) CO2, HNO2
в) SO3, C2H4
г) SO2, HNO3
Тест «Химическая кинетика»
2NO(г) + O2(г) ⇄ 2NO2(г)
1. Напишите выражение закона действующих масс для этой реакции.
а) U = kCNOСO2
б) U = kC2NOСO2
в) U = kC2NOСO2C2NO2
г) U = kC2NO2
2. Запишите выражение константы равновесия для реакции:
а) Кр = [NO]2[O2]/[NO2]2
б) Кр = [NO][O2]/ [NO2]
в) Кр = [NO2]2/[NO]2[O2]
г) Кр = [NO2]/[NO][O2]
3. Как изменится скорость прямой реакции при разбавлении реагирующей смеси в 3 раза:
а) уменьшится в 3 раза
б) увеличится в 9 раз
в) уменьшится в 27 раз
г) не изменится
4. Как изменится скорость прямой реакции при увеличении концентрации NO в 5 раз:
а) увеличится в 5 раз
б) увеличится в 25 раз
в) увеличится в 125 раз
г) увеличится в 32 раза
5. Чтобы сместить равновесие в системе в сторону прямой реакции, необходимо:
а) повысить давление
б) понизить давление
в) понизить концентрацию NO и О2
г) повысить концентрацию NO и О2
6. Во сколько раз увеличится скорость химической реакции при увеличении температуры на 40о, если температурный коэффициент равен 2:
а) 16
б) 10
в) 8
г) 32
7. Чтобы сместить равновесие в системе в сторону обратной реакции, приведенной в начале теста, необходимо:
а) повысить давление
б) повысить концентрацию О2
в) понизить концентрацию NO2
г) повысить концентрацию NO2
8. На сколько градусов надо понизить температуру, чтобы скорость реакции уменьшилась в 27 раз при температурном коэффициенте, равном 3:
а) 3
б) 30
в) 27
г) 9
Тест «Теория электролитической диссоциации»
1. Самопроизвольный распад молекул растворенного (иногда расплавленного) вещества на катионы и анионы называется…
1) электролизом;
2) ионной проводимостью;
3) гомогенным катализом;
4) электролитической диссоциацией.
2. Численное значение степени диссоциации электролита в растворе при данной температуре зависит от…
1) атмосферного давления;
2) наличия катализатора;
3) концентрации раствора;
4) агрегатного состояния электролита.
3. В зависимости от численного значения степени диссоциации α разбавленных растворов электролиты подразделяют на: а) сильные, б) слабые:
1) а) α = 60%; б) α = 40%;
2) а) α ≥ 80%; б) α ≤ 20%;
3) а) α ≥ 30%; б) α ≤ 3%;
4) а) α ≥ 0,3; б) α ≤ 0,03.
4. Степень диссоциации сульфита калия в водном растворе с концентрацией 1 моль/л равна 0,75. Вычислите концентрацию ионов калия в растворе.
1) 0,75 моль/л;
2) 2,25 моль/л;
3) 1,5 моль/л;
4) 2 моль/л.
5. Величиной, характеризующей диссоциацию и не зависящей от концентрации раствора, является…
1) константа гидролиза;
2) ионное произведение воды;
3) константа диссоциации;
4) отношение количества растворенного электролита к общей массе раствора.
6. Поскольку диссоциация электролита КА на катион К+ и анион А- является обратимым равновесным процессом КА…К+ + А-, то к нему применим закон действующих масс, в соответствии с которым определяется константа равновесия, называемая в таких случаях константой диссоциации Кд. Константа диссоциации определяется по формуле:
1) Кд = [КА][К+][А-];
2) Кд = [КА]/( [К+][А-]);
3) Кд = [К+][А-]/[КА];
4) Кд = [КА].
Квадратные скобки обозначают равновесную концентрацию.
7. Процесс электролитической диссоциации нитрата бария описывается уравнением:
1) Ba(NO3)2 ↔Ba4+ + 2NO32-;
2) Ba(NO3)2 ↔ Ba2+ + 2N5+ + 6O2-;
3) Ba(NO3)2 ↔ Ba3+ + N2O4- + 2O-;
4) Ba(NO3)2 ↔Ba2+ + 2NO3-.
8. Чему равна концентрация ионов Н+ в растворе КОН с концентрацией 0,01 моль/л при условии, что гидроксид калия продиссоциировал нацело?
1) 10-12 моль/л;
2) 0,01 моль/л;
3) 10-14 моль/л;
4) поскольку раствор щелочной, в нем не могут присутствовать ионы Н+ (т. е. [H+] = 0).
9. Рассчитайте рН: а) соляной кислоты с концентрацией 0,1 моль/л; б) водного раствора гидроксида калия с концентрацией 1,0 моль/л, считая, что указанные вещества диссоциируют полностью.
1) a) 1; б) 14;
2) a) 7; б) 7;
3) a) 14; б) 0;
4) a) 2; б) 12;
10. Рассчитайте концентрацию ионов водорода в растворе аммиака с концентрацией 1,5 моль/л. (Кд гидроксида аммония равна 1,7 ∙ 10-5) .
1) [Н+] = 3 ∙ 10-10 моль/л;
2) [Н+] = 2 ∙ 10-2 моль/л;
3) [Н+] = 2 ∙ 10-12 моль/л;
4) [Н+] = 4 ∙ 10-1 моль/л;
11. Диссоциацию малорастворимых веществ (типа AgCl или BaSO4) характеризуют с помощью специальной константы, называемой…
1) константой Больцмана;
2) произведением растворимости;
3) степенью ионизации;
4) ионным произведением.
12. Для уравнения реакции CuSO4 + KOH = … сокращенное ионное уравнение имеет вид:
1) 2К+ + SO42- = К2SO4;
2) Cu2+ + SO42- + 2К+ + 2OH- = Cu(OH)2↓+ К2SO4;
3) CuSO4 + 2OH- = Cu(OH)2↓ + SO42-;
4) Cu2+ + 2OH- = Cu(OH)2↓.
13. С каким веществом вступит в реакцию обмена в водном растворе бромид бария?
1) HNO3;
2) CuSO4;
3) CuCl2;
4) LiOH;
14. Ниже перечислены ионы, одновременно обнаруженные в одном из водных растворов:
1) Ba2+, NO3-, SO42-, NH4+, Br-;
2) Zn2+, Cl-, Fe2+, Ca2+, OH-;
3) Cu2+, Br-, S-2, Ag+, NO3-;
4) Fe2+, SO42-, Na+, NH4+, NO3-;
15. Какая соль не может вступать в обменные реакции в водном растворе?
1) нитрат аммония;
2) хлорид натрия;
3) нитрат калия;
4) нитрит калия.
Тест «Гидролиз»
1. Какая из перечисленных солей гидролизу не подвергается:
а) BeSO4;
б) Cu(NO3)2;
в) NH4CH3COO;
г) NaNO3
2. Водный раствор какой соли имеет нейтральную среду:
а) CaSO4;
б) Fe(NO3)3;
в) CdCl2;
г) CoSO4
3. Для водного раствора соли укажите реакцию среды:
1) NaClO4;
2) K3PO4;
3) MgCl2;
4) FeCl2
а) pH = 7;
б) pH > 7;
в) pH < 7
4. При гидролизе какой из приведенных солей образуется кислая соль:
а) NiSO4;
б) Na2S;
в) AlCl3;
г) Zn(NO3)2
5. В каком случае при сливании водных растворов солей происходит полный гидролиз продукта реакции:
а) Al2(SO4)3 + MgSO4 + H2O →
б) NH4Cl + CaCl2 + H2O →
в) Zn(NO3)2+ K2CO3 + H2O →
г) SrCl2 + KNO2 + H2O →
6. Гидролиз какой соли протекает по уравнению:
PO43– + HOH → HPO42– + OH–
а) К2HPO4;
б) NaH2PO4;
в) AlPO4;
г) K3PO4
7. Добавление какого из приведенных веществ может увеличить степень гидролиза фосфата калия:
а) HCl;
б) K3PO4;
в) KCl;
г) NaOH
8. В Водном растворе какой соли фенолфталеин имеет малиновую окраску:
а) NaClO4;
б) K3PO4;
в) ZnCl2;
г) NH4Cl
Приложение 3
Вопросы к коллоквиуму «Химическая связь»
Теоретическая часть
1. Понятие химической связи, ее природа, условия образования. Типы химической связи. Общие свойства химической связи (длина связи, энергия связи).
2. Ковалентная связь. Квантово-механическое описание ковалентной связи.
3. Основные положения теории валентных связей (ТВС). Механизмы образования ковалентной связи. σ– и π– связи в свете ТВС.
4. Свойства ковалентной связи (полярность, поляризуемость, кратность, насыщаемость, направленность).
5. Гибридизация атомных орбиталей. Типы гибридизации и геометрия молекул.
6. Ионная связь. Механизм образования. Свойства ионной связи. Особенности веществ с ионной связью. Сравнительный анализ свойств веществ с ковалентной ионной связью.
7. Металлическая связь, условия образования, свойства. Зонная теория строения и проводимости металлов. Особенности веществ с металлической связью.
8. Водородная связь, образование, свойства. Влияние водородной связи на свойства веществ.
9. Силы межмолекулярного взаимодействия (ориентационное, индукционное, дисперсионное). Роль взаимодействий.
10. Кристаллическое, аморфное и жидкое состояние вещества
11. Типы кристаллических решеток
Практические задания
1. Рассмотрите с позиций ТВС механизмы образования химической связи в молекулах О2 и СО, ионах NH4+ и BF4– .
2. В какой из молекул: HI, HF, HBr, HCl дипольный момент наибольший?
3. В молекулах каких химических соединений имеется 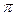 -связь: CaO, CaCl2, N2, SO3, H2S, HNO3?
-связь: CaO, CaCl2, N2, SO3, H2S, HNO3?
4. Каким должно быть распределение общей электронной плотности в поле двух связываемых ядер в молекулах KCl, Cl2, HCl?
5. Как изменяется характер химической связи в молекулах хлоридов элементов главной подгруппы VI группы периодической системы?
6. Как изменяется характер в молекулах хлоридов элементов III периода? Почему?
7. Как и почему изменяется прочность химической связи и химическая активность в ряду Сl2 – O2 – N2 – H2?
8. Какой тип гибридизации атомных орбиталей осуществляется в молекулах: SiO2, SiCl4, BH3?
Приложение 4
Дата добавления: 2015-09-11; просмотров: 1952;
