Порівняльна характеристика двох класів АРС-аз
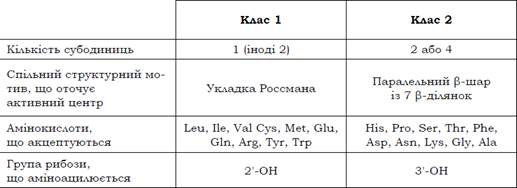
Центральна частина поліпептидного ланцюга АРС-ази формує активний центр (сайт зв’язування амінокислоти), в оточенні якого реалізується спільний для ферментів одного класу структурний мотив: для першого класу – укладка Россмана, для другого – приблизно плоский паралельний β-шар із семи β-ділянок (рис. 4).Як видно з табл. 2, амінокислоти з подібними властивостями часто є субстратами АРС-аз різних класів залежно від розміру амінокислот: великі потрапляють до першого класу, маленькі – до другого (наприклад, Tyr і Phe, Glu і Asp, Arg і Lys). Відповідно, активний центр АРС-аз першого класу розташований у порівняно неглибокій порожнині на поверхні ферменту, другого класу – у глибшому кармані.

Рис. 4. Структури АРС-аз першого (мономерна Glu-тРНК-синтетаза, 1G59) та другого (Asp-тРНК-синтетаза, гомодимер, 1ASY) класів.
Із частини молекули, яка утворює спільний структурний мотив, випетльовуються інші структурні домени, які, разом із N- або С-кінцевими доменами беруть участь у взаємодії з тРНК. АРС-ази двох класів упізнають різні елементи структури тРНК: маленький жолобок акцепторного стебла, D-петля та антикодонова петля для першого класу; великий жолобок акцепторного стебла, варіабельна та антикодонова петлі для другого (рис. 5). Причому специфічність упізнання тРНК залежить у першу чергу від взаємодій з акцепторним стеблом: штучна акцепторна частина (міні-тРНК) здатна специфічно зв’язатися з АРС-азою та акцептувати амінокислоту.
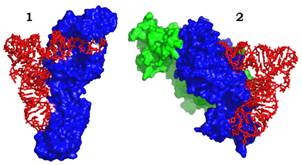
Рис. 5. Комплекси тРНКGlu (1 клас, 1G59) і тРНКAsp (2 клас, 1ASY) з відповідними АРС-азами. З димерною АРС-азою зв’язано дві молекули тРНК. На даній проекції видно лише одну з них.

Рис. 6. Подвійне сито на прикладі Ile тРНК-синтетази.
Специфічність зв’язування АРС-азою такого великого ліганду, як тРНК, не становить значної проблеми: велика кількість контактів дозволяє досить легко дискримінувати різні типи тРНК за рахунок різниці у вільній енергії зв’язування. Амінокислоти, навпаки, є маленькими лігандами (до того ж іноді з дуже схожою структурою), з яким неможливо реалізувати велику кількість взаємодій. Тим не менш, середня частота помилок при аміноацилюванні тРНК становить приблизно 10–6 – такий рівень точності неможливо досягти просто за рахунок різниці у вільній енергії зв’язування, яка не може сильно відрізнятися для різних амінокислот. Відповідно, АРС-ази використовують певну систему корекції помилок за механізмом так званого подвійного сита. Наприклад, активний центр Ile-тРНК-синтетази (рис. 6) здійснює первинне вибракування частини амінокислот досить великого розміру на етапі зв’язування / активування, інші амінокислоти (включаючи Ile) піддаються активуванню. На другому етапі всі аміноациладенілати, що містять більш маленькі порівняно з Ile амінокислоти, гідролізуються в іншому активному центрі (центр редагування), а Ile переноситься на тРНК, оскільки його розмір не дозволяє йому зв’язатися з центром редагування. У результаті дуже близький до Ile за структурою Val акцептується тРНКIle в одному випадку з 180 тис. Інші АРС-ази можуть здійснювати редагування помилок уже після акцептування амінокислоти, коли аа-тРНК упізнається як ціле, і неспоріднена амінокислота відщеплюється.
Дата добавления: 2015-09-11; просмотров: 1067;
