Структура рибосоми
Структуру рибосоми за результатами рентгеноструктурного аналізу її кристалів показано в різних проекціях на рис. 8–10, де також схематично зображено зовнішню анатомію субодиниць та їхнє розташування у складі рибосоми відносно одна одної та деяких інших елементів системи трансляції.
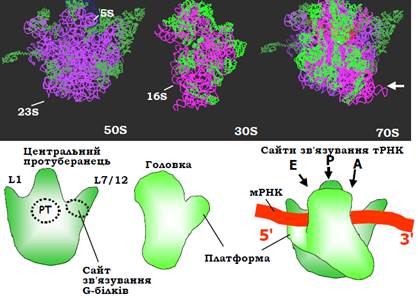
Рис. 8. Структура рибосоми Thermus thermophilus та її субодиниць (1GIX, 1GIY), показано лише основні ланцюги РНК і білків (білки пофарбовано зеленим). Окремі субодиниці орієнтовані інтерфейсами взаємодії між ними до глядача, у складі рибосоми орієнтація великої субодиниці збережена. Білою стрілкою позначено напрям зору, в якому структуру зображено на рис. 9. Унизу: схематичне зображення структур субодиниць та їхнього комплексу в тих самих проекціях, РТ – пептидилтрансферазний центр.
Від основного досить монолітного тіла великої субодиниці відходять три характерні відростки: виріст L1, палець (стебло) L7/12, сформовані відповідними рибосомними білками, і центральний протуберанець, утворений комплексом певних білків з рРНК 5S. Два окремі структурні домени – головка та платформа – відходять від тіла маленької субодиниці.
У складі рибосоми можна виділити три основні зони контактів між субодиницями: головка – центральний протуберанець; платформа – виріст L1; центральні частини основного тіла обох субодиниць. Усі структурні елементи рухливі: можливим є переміщення головки й пальця L7/12, обертання малої субодиниці навкруг нормалі до поверхні великої субодиниці на ~6° проти годинникової стрілки тощо. Рухи структурних елементів рибосоми в зонах контактів мають важливе значення для її функціонування, оскільки саме на інтерфейсі між субодиницями знаходяться всі активні центри та сайти взаємодії з елементами системи трансляції:

Рис. 9. Структура рибосоми та її субодиниць у комплекс із трьома молекулами тРНК з рис. 8 у іншій проекції – з боку входу аа-тРНК до А-сайта. Білою стрілкою позначено напрям зору, у якому структуру зображено на рис. 10. Унизу: схематичне зображення у тій самій проекції, крайня права схема – велика субодиниця в розрізі.
• В основі центрального протуберанця розташований пептидил-трансферазний центр (рис. 8, 9), який відповідає за каталіз реакції синтезу пептидного зв’язку. Від пептидил-трансферазного центру через тіло великої субодиниці відходить тунель – канал виходу поліпептидного ланцюга, що синтезується (рис. 9).
• В основі пальця L7/12 міститься сайт зв’язування G-білків (рис. 8) – факторів трансляції, детальне описання яких наведено нижче.
• У щілині між платформою та головкою маленької субодиниці відбувається взаємодія з мРНК (рис. 8, 9).
• Сайти зв’язування тРНК розташовані між двома субодиницями: антикодонові частини тРНК взаємодіють з мРНК і маленькою субодиницею, акцепторні частини – з великою субодиницею (рис. 9, 10). Рибосома містить три такі сайти: А-сайт, де відбувається зв’язування аа-тРНК; Р-сайт, де з рибосомою взаємодіє пептидилт-РНК (тРНК, до якої приєднаний пептидил – ланцюг, що синтезується); Е-сайт (від exit), де міститься деаміноацильована тРНК перед її звільненням з рибосоми.
Акцепторні частини тРНК, розташовані в А- і Р-сайтах, наближені одна до одної (рис. 10, 11) і взаємодіють з великою субодиницею в зоні пептидилтрансферазного центру. Кількість контактів з тРНК у Р-сайті є більшою, ніж кількість контактів, що утримують молекулу тРНК в А-сайті.
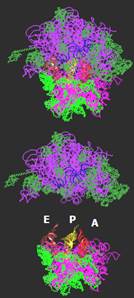
Рис. 10. Вид зверху (по стрілці на рис. 9) на структуру рибосоми та її субодиниць у комплексі з трьома молекулами тРНК.
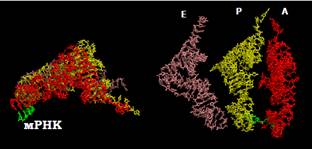
Рис. 11. Взаємне розташування трьох молекул тРНК у рибосомі (дві проекції приблизно збігаються з проекціями на рис. 9 і 10).
Аа-тРНК потрапляє до рибосоми через щілину між субодиницями (рис. 9), розмір якої може змінюватись унаслідок рухливості структурних елементів рибосоми. Так само й розмір воріт, через які тРНК виходить із Е-сайта, модулюється рухливістю виросту L1. Функціональну схему рибосоми наведено на рис. 12: систему зображено в момент перед додаванням четвертої амінокислоти до ланцюга, що синтезується; показано аа-тРНК, пептидил-тРНК і деаміноацильовану тРНК, що зв’язані відповідно з А-, Р- і Е-сайтами. Центральні сайти, навколо яких відбувається вся робота рибосоми – сайти зв’язування тРНК – формуються обома субодиницями. Між субодиницями існує своєрідне відносне розділення праці: маленька субодиниця, яка взаємодіє з мРНК та антикодоновими частинами тРНК, відповідає головним чином за декодуючу функцію рибосоми, а велика, яка взаємодіє з акцепторними частинами тРНК – за каталітичну функцію. Рибосомні РНК становлять ~2/3 маси рибосоми й саме вони визначають її структуру та функції. Полінуклеотидний ланцюг рРНК утворює велику кількість подвійних спіралей, з’єднаних петлями, – переважно це шпильки, проте відбувається і спарювання між віддаленими по ланцюгу ділянками. Загалом ланцюг утворює складну просторову структуру, де подвійні спіралі взаємодіють одна з одною та з одноланцюговими ділянками. Зокрема, аденозини одноланцюгових ділянок досить часто взаємодіють з маленьким жолобком подвійних спіралей, стабілізуючи структуру.
У складі 16S рРНК близько половини нуклеотидів залучено до ~60 коротких дволанцюгових ділянок середньою довжиною вісім пар основ. Але зазвичай у складі 16S РНК виділяють 45 більш-менш суцільних (із короткими неспареними ділянками всередині) подвійних спіралей. За своєю загальною Y-подібною формою 16S рРНК майже не відрізняється від маленької субодиниці рибосоми (рис. 13, порівн. рис. .8) – просторова структура чітко розділяється на чотири структурні домени: 5′-кінцевий формує тіло маленької субодиниці, центральний – платформу, так званий 3′-кінцевий мажорний домен – головку, 3′-кінцевий мінорний, який складається з довгої спіралі 44 (порядковий номер) і коротшої останньої спіралі 45, формує інтерфейс взаємодії з великою субодиницею. На цей РНК-скелет у складі маленької субодиниці нарощуються білки, однак загальна форма зберігається. При цьому сайти зв’язування мРНК і антикодонових частин тРНК формуються переважно 3′-кінцевою зоною 16S рРНК майже без участі білків; взаємодія між субодиницями також переважно забезпечується контактами РНК.

Рис. 8.12. Функціональна схема рибосоми: червоною стрілкою позначено напрямок руху при трансляції, амінокислоти пронумеровано відповідно до порядку включення їх до ланцюга.
Еукаріотична 18S рРНК є гомологічною 16S, відрізняючись кількома вставками. У складі 23S рРНК розрізняють шість структурних доменів, але вони тісно взаємодіють один з одним. Порівняно із 16S рРНК, ця структура є значно монолітнішою (рис. 13). Така монолітність зумовлена головною каталітичною функцією великої субодиниці – каталіз не передбачає конформаційної рухливості, а навпаки, вимагає жорсткості просторової організації. Каталітична активність великої субодиниці пов’язана саме з певною зоною у складі 23S рРНК, яка також взаємодіє з акцепторними частинами тРНК. Порівняно невелика 5S рРНКу комплексі з певними рибосомними білками взаємодіє з 23S, формуючи центральний протуберанець.

Рис. 13. Рибосомні РНК у складі маленької (2B9O) і великої (2B9P) субодиниць рибосоми Thermus thermophilus з боку інтерфейсу взаємодії (як на рис. 8). Указано структурні домени рРНК 16S, довга спіральу складі 3′-кінцевого мінорного домену – спіраль 44.
Еукаріотична 5,8S рРНК є гомологічною 5′-кінцевій зоні 23S. Узагалі еукаріотичні 28S і 5,8S рРНК, які утворюють міцний комплекс між собою, – це ніби трохи подовжена за рахунок вставок 23S РНК, розділена на дві нерівні частини. Рибосомні білки розміщуються на поверхні рРНК (відповідно, і на поверхні рибосоми). У складі маленької субодиниці платформа, щілина між платформою та головкою, а також інтерфейс взаємодії з великою субодиницею майже не містять білків, котрі розміщені головним чином на зовнішньому боці субодиниці (рис. 8). По поверхні великої субодиниці білки розподілені рівномірніше, хоча збідненим на них є інтерфейс взаємодії з маленькою субодиницею, і навпаки, палець L7/12 утворений кількома копіями відповідних білків без участі РНК.
Більшість рибосомних білків мають дві частини у своїй структурі: глобулу, розміщену на поверхні рибосоми, і позитивно заряджений хвіст (нерегулярна ділянка, петля або одна–дві окремі α-спіралі), який занурюється в сітку рРНК і стабілізує структуру останньої (рис. 14). У деяких білків глобула відсутня. Отже, усі рибосомні білки (за винятком L7/12) взаємодіють з рРНК, хоча не всі мають високу спорідненість до вільної рРНК. Збирання субодиниць рибосоми з рРНК та білків (може бути здійснено in vitro без участі будь-яких факторів) відбувається поступово, через чотири – пять стадій: зв’язування частини білків на кожній стадії індукує конформаційну зміну рРНК у складі комплексу, що викликає спорідненість до нової порції білків.

Рис. 14. Приклади рибосомних білків у структурі рибосоми (2B9O, 2B9P). Унизу: взаємодія білка L15 з рРНК 23S.
Головна роль рибосомних білків – підтримувати функціонально активну структуру рРНК. Хоча рРНК відповідає за майже всі активності рибосоми, активної конформації вона набуває лише в комплекс із рибосомними білками. Крім того, деякі білки беруть участь у взаємодіях з елементами системи трансляції. Наприклад, білок S1, що міститься поблизу від сайта зв’язування мРНК, сприяє розплітанню дволанцюгових шпильок у складі матриці; комплекс S1–S18–S21 взаємодіє з мРНК, а також ініціаторною тРНК при ініціації трансляції; білок L10 сумісно з певною ділянкою 23S рРНК і білком L11 організує сайт зв’язування G-білків у основі стебла L7/12.
Дата добавления: 2015-09-11; просмотров: 2458;
