Зв'язування аа-тРНК з А-сайтом рибосоми
Роль фактора EF1 і гідролізу GTP. Щоб аа-тРНК могла потрапити до рибосоми, рибосома має опинитися в певному – відкритому структурному стані з розширеним каналом між субодиницями з боку стебла L7/12 (див. рис. 9). Крім того, така відкрита форма рибосоми не допускає дуже міцної взаємодії з аа-тРНК, тобто сприяє її легкій дисоціації в разі невідповідності між кодоном і антикодоном. Однак зрозуміло, що відкрита форма рибосоми із частково порушеними контактами (енергетично вигідними взаємодіями) між субодиницями має характеризуватися підвищеною вільною енергією, тобто є малоймовірною. Інший важливий аспект полягає в тому, що на етапі первинного перебору аа-тРНК з різними антикодонами необхідно повністю виключити для акцепторної частини тРНК можливість випадково потрапити до пептидил-трансферазного центру. Узагалі, для такого великого ліганду, як тРНК, існує кінетичний бар’єр асоціації / дисоціації: велика кількість контактів з лігандом вимагає утворювати / руйнувати їх одночасно – проміжні стани з лімітованим набором контактів мають забезпечити прискорення обох процесів. Роль EF1 саме й полягає у вирішенні зазначених проблем:
• Взаємодія EF1 з акцепторною частиною аа-тРНК залишає тільки антикодонову частину вільною для взаємодій з рибосомою (і зв’язаною з нею мРНК).
• При зв’язуванні потрійного комплексу, EF1 (який при цьому зв’язаний з акцепторною частиною аа-тРНК) взаємодіє із сайтом у основі стебла L7/12, що виключає контакт акцепторного стебла тРНК з пептидил-трансферазним центром.
• EF1·GTP має підвищену спорідненість до відкритої форми рибосоми, тобто подібно до того, як GTP перемикає конформацію самого EF1, потрійний комплекс EF1·GTP-аа-тРНК фіксує відкриту форму рибосоми, яка стає енергетично вигідною за рахунок енергії взаємодій з EF1 (рис. 18).
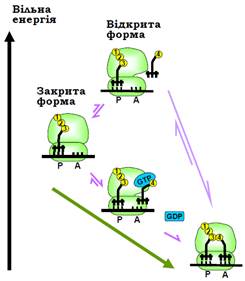
Рис. 18. Зв’язування з А-сайтом рибосоми аа-тРНК у вільному стані та в комплексі з EF1·GTP. Різні стани системи розміщені на різних рівнях відповідно до їхньої вільної енергії. Зелена стрілка вказує оптимальний шлях процесу. Показано тільки два сайти тРНК.
Отже, за умови присутності EF1·GTP здійснюється швидка й недуже міцна взаємодія аа-тРНК з рибосомою (головним чином завдяки взаємодії EF1 з основою стебла L7/12), яка також швидко змінюється дисоціацією: випробування, під час яких антикодонова частина тРНК намагається впізнати кодон. Якщо таке впізнання відбувається (див. нижче), спрацьовує GTP-азна активність EF1 – після гідролізу GTP-фактор дисоціює, що дозволяє акцепторній частині аа-тРНК остаточно розміститися в А-сайті.
Зв’язування аа-тРНК є внутрішньою властивістю рибосоми: in vitro зв’язування може відбуватися без участі будь-яких факторів, оскільки супроводжується зниженням вільної енергії. Проте позафакторне зв’язування є досить повільним через наявність на його шляху енергетичного бар’єра – високоенергетичного відкритого стану рибосоми (рис. 18). Таким чином, EF1 не зумовлює зв’язування аа-тРНК, а тільки суттєво прискорює цей процес. Можна сказати, що EF1 здійснює каталіз конформаційних перетворень рибосоми за рахунок спорідненості до проміжного інтермедіатного стану.
Щодо гідролізу GTP, то він потрібен лише для заміни ліганду з метою позбавитися цієї спорідненості й забезпечити дисоціацію EF1 і повернення рибосоми до закритого стану, необхідного для наступної стадії елонгаційного циклу. Але це має відбутися лише за умови впізнання кодона антикодоном аа-тРНК.
Упізнання кодона. Коли під час первинного зв’язування після кількох випробувань у межах А-сайта на маленькій субодиниці опиняється нарешті комплементарний антикодон, між ним і кодоном має утворитися коротка подвійна спіраль. Оскільки вона коротка (три пари основ), то досить нестабільна: кодон-антикодонова взаємодія за межами рибосоми є неефективною. При цьому рибосома (передусім маленька субодиниця) не тільки створює особливе середовище, яке стабілізує кодон-антикодонову спіраль, але й сприяє підвищенню специфічності – ефективно дискримінує споріднені та неспоріднені до даного кодону антикодони. При утворенні комплементарної подвійної спіралі, з її маленьким жолобком взаємодіють два консервативні аденозини рРНК 16S (з порядковими номерами 1492 і 1493 – розташовані у верхній частині спіралі 44, див рис. 13), утворюючи водневі зв’язки з 2′ОН-групами рибоз нуклеотидів кодона й антикодона (рис. 19). Така взаємодія, що реалізується лише за умови комплементарності, стабілізує перші дві (відносно позицій кодона) нуклеотидні пари. Друга нуклеотидна пара додатково стабілізується, також через маленький жолобок, взаємодією з консервативним G530 рРНК 16S. Третя пара кодон-антикодонової спіралі теж взаємодіє з певним цитидином рРНК 16S, але ця взаємодія менш специфічна й допускає неоднозначність спарювання (див. підрозділ, де йдеться про тРНК).
Взаємодії нуклеотидів рРНК 16S із кодон-антикодоновою спіраллю не тільки підвищують специфічність упізнання кодона, але й мають інший важливий наслідок. Як показано на рис. 19, для реалізаціїцих взаємодій А1492 і А1493 мають бути переорієнтованими відносно сусідніх нуклеотидів. Така локальна конформаційна перебудова запускає каскад конформаційних змін в інших частинах рРНК 16S за принципом доміно, що спричиняє глобальну конформаційну перебудову всієї маленької субодиниці. Зокрема, головка субодиниці переміщується в бік великої субодиниці (див. рис. 9), міцно замикаючи антикодонову частину аа-тРНК на кодоні мРНК. Оскільки субодиниці рибосоми взаємодіють між собою, структурна перебудова маленької субодиниці не залишається непомітною для великої: конформаційні зміни відбуваються і тут. Одним із результатів перебудови є зміна взаємодії між EF1 і відповідним сайтом його зв’язування в основі стебла L7/12, яка приводить до активації GTP-ази, – відбувається гідроліз GTP, конформаційна перебудова EF1 із втратою спорідненості до рибосоми та тРНК і дисоціація фактора.
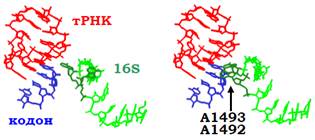
Рис. 19. Взаємодія в межах А-сайта на маленькій субодиниці між кодоном, антикодоновою петлею тРНК і частиною рРНК 16Sу випадку неспорідненого (ліворуч, 1N36 – друга кодон-антикодонова пара основ є не комплементарною) і спорідненого (праворуч, 1IBM) антикодонів.
Акомодація аа-тРНК завершує першу стадію елонгаційного циклу. Перед гідролізом GTP розміщення аа-тРНК на рибосомі суттєво відрізняється від кінцевої точки процесу зв’язування – локалізації в А-сайті. Оскільки сайти зв’язування тРНК формуються двома субодиницями (мають дві “половини”), остаточний А-сайт позначають як А/А. У складі комплексу з EF1 антикодонова частина розміщена в А-сайті на маленькій субодиниці, але акцепторна частина утримується в основі стебла L7/12 на великій – так зване А/Т положення (рис. 20).
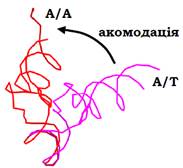
Рис. 20. А/Т (1QZA) і А/А (1QZB) положення аа-тРНК на рибосомі до й після акомодації відповідно.
При цьому антикодонове стебло суттєво вигинається – фіксація антикодона та акцепторного стебла підтримує напружену конформацію тРНК. Після гідролізу GTP, коли EF1 дисоціює, один із фіксаторів зникає – тРНК, ніби пружина, розпрямляється, її акцепторне стебло автоматично опиняється в А-сайті на великій субодиниці – у зоні пептидил-трансферазного центру. Ефективність цього процесу акомодації (рис. 20) залежить від жорсткості фіксації антикодонової петлі тРНК на маленькій субодиниці. Якщо взаємодія між кодоном і антикодоном не є повністю комплементарною, аа-тРНК просто дисоціює від рибосоми – це друга (після первинного зв’язування) можливість виправити помилку впізнання кодона.
Загальний сценарій зв’язування аа-тРНК з рибосомою зображено на рис. 21.
• На першому етапі початкового відбору аа-тРНК відбувається швидка асоціація / дисоціація потрійних комплексів EF1·GTP–аа-тРНК з відкритою формою рибосоми, яка фіксується за рахунок взаємодій з EF1. Відкрита форма сприяє також дисоціації деаміноацильованої тРНК з Е-сайта рибосоми (не показано на рис. 21).
• При утворенні комплементарної кодон-антикодонової подвійної спіралі, вона стабілізується за рахунок взаємодій з нуклеотидами рРНК 16S. Локальна конформаційна зміна 16S, яка є наслідком цих взаємодій, спрацьовує як тригер структурної перебудови спочатку маленької, потім великої субодиниць. Унаслідок перебудови антикодонова петля тРНК жорстко замикається на маленькій субодиниці, акцепторне стебло – на великій у основі пальця L7/12, і EF1 набуває GTP-азної активності.
• Гідроліз GTP розмикає ланцюг подій на дві частини, роблячи його необоротним. Після гідролізу EF1·GDP дисоціює, залишаючи аа-тРНК у напруженій конформації.
• Далі процес розгалужується: або, при недостатньо міцних кодон-антикодонових взаємодіях, відбувається дисоціація аа-тРНК, яка повертає систему до вихідного стану, або здійснюється акомодація – релаксація напруженої аа-тРНК, яка виводить її акцепторний кінець до пептидил-трансферазного центру.
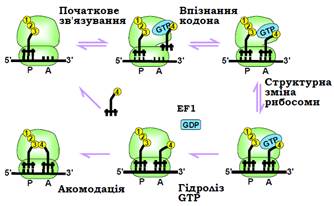
Рис. 21. Схема основних подій при зв’язуванні аа-тРНКз А-сайтом рибосоми. Е-сайт тРНК не показано для спрощення.
Загальним наслідком процесу зв’язування, таким чином, є повна підготовка системи трансляції до наступного етапу елонгаційного циклу.
Дата добавления: 2015-09-11; просмотров: 991;
