Транспептидація
Реакція перенесення пептидилу – транспептидація – полягає в руйнуванні ковалентного зв’язку між карбоксильною групою С-кінцевої амінокислоти пептидилу та 3′-кінцевою ОН-групою пептидил-тРНК і утворенні натомість пептидного зв’язку між звільненою карбоксильною групою та аміногрупою амінокислоти у складі аа-тРНК. Таким чином, при транспептидації пептидил переноситься з Р- до А-сайта рибосоми: в А-сайті опиняється пептидил-тРНК із подовженим на одну амінокислоту пептидилом, у Р-сайті залишається деаміноацильована тРНК (див. рис. 15).
Стандартна вільна енергія гідролізу зв’язку між пептидилом і тРНК оцінюється приблизно в –7,5 ккал/моль, енергія гідролізу пептидного зв’язку –0,5 ккал/моль. Отже, загальний енергетичний баланс транспептидації ~ –7,0 ккал/моль: це спонтанний процес, який не потребує джерел енергії – енергію було заощаджено при аміноацилюванні тРНК
Процес транспептидації, що відбувається безпосередньо після акомодації аа-тРНК, є найшвидчим етапом елонгаційного циклу. Каталіз реакції здійснюється пептидил-трансферазним центром великої субодиниці рибосоми, розташованим в основі центрального протуберанця (див. рис. 8) і формується пептидил-трансферазною петлею рРНК 23S. У радіусі ~18 Å від субстратів реакції немає жодної білкової хімічної групи, тобто рибосома – це рибозим. Слід, проте, ще раз зауважити, що вільна рРНК 23S не має каталітичної активності – активна конформація рРНК реалізується лише в комплекс із певним мінімальним набором білків.
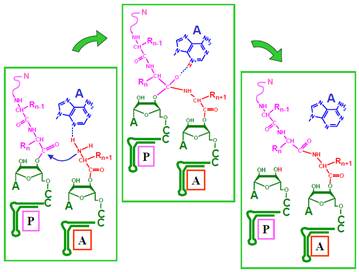
Рис. 22. Процес перенесення пептидилу з Р-сайта на аа-тРНК в А-сайті через інтермедіатну сполуку, стабілізовану взаємодією з аденозином (А синього кольору) рРНК 23S. Амінокислотні бокові залишки R-пронумеровані в порядку приєднання їх до поліпептидного ланцюга.
Реакція транспептидації проходить через утворення інтермедіатної сполуки з формуванням зв’язку між N аміногрупи аа-тРНК і С, яким пептидил приєднаний до тРНК, атом оксигену набуває при цьому негативного заряду (рис. 22). Утворенню інтермедіату передує захоплення протона аміногрупи атомом N3 аденіну, що знаходиться в активному центрі. Легка іонізація N3 зумовлена його особливим мікрооточенням у складі рРНК 23S, протонований азот стабілізує негативно заряджений О. Далі протон переноситься на 3′ ОН-групу пептидил-тРНК, яка, відповідно, стає деаміноацильованою – втрачає зв’язок із С, замість якого остаточно формується пептидний зв’язок.
Механізм каталізу транспептидації є цілком аналогічним до такого білкових ферментів: рибосома здійснює жорстке взаємне орієнтування субстратів у активному центрі (і ця обставина – ентропійний каталіз – є головним фактором прискорення реакції транспептидації), а також завдяки створенню специфічного мікрооточення певної хімічної групи (аденіну) забезпечує стабілізацію проміжного високоенергетичного стану.
Дата добавления: 2015-09-11; просмотров: 1676;
