Транслокація
Результатом транспептидації є значне перегрупування лігандів, зв’язаних з рибосомою: пептидил-тРНК опиняється в А-сайті, деаміноацильована тРНК – у Р-сайті. Ураховуючи підвищену спорідненість акцепторної частини пептидил-тРНК до Р-сайта, рибосома має спонтанно пересунутися вздовж мРНК у напрямку до її 3′-кінця, і таке пересування – транслокація – має розпочатися з руху великої субодиниці (рис. 23). На проміжній стадії виникають гібридні сайти А/Р і Р/Е – стани, коли акцепторні частини тРНК уже знаходяться в Р (або Е) сайті на великій субодиниці, але антикодонові частини – ще в А (або Р) сайті. Зрозуміло, що рух субодиниць передбачає послаблення взаємодій між ними – певний розблокований після транспептидації, відкритий структурний стан рибосоми. Зрозуміло також, що послаблення взаємодій між субодиницями є енергетично невигідним. Відповідно, хоча транслокація є внутрішньою властивістю рибосоми і відбувається спонтанно (вільна енергія знижується в кінцевому стані за рахунок високої спорідненості пептидил-тРНК до Р-сайта), швидкість руху є дуже повільною в позафакторній системі in vitro, оскільки процес проходить через проміжний високоенергетичний стан. In vivo фактором прискорення процесу є білок EF2 (інше позначення – EFG).
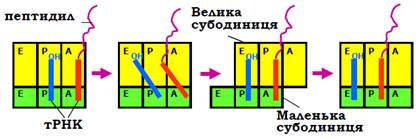
Рис. 23. Схема транслокації рибосоми через проміжну стадію гібридних сайтів.
Частина молекули EF2 є гомологічною білку EF1 – також має сайт зв’язування GTP/GDP і також взаємодіє з великою субодиницею рибосоми в основі пальця L7/12. Але у складі білка є ще один додатковий домен, який мімікрує під структуру антикодонової частини тРНК, структура білка в цілому нагадує комплекс EF1 – тРНК (рис. 24).
Фактор EF2 існує у принаймні чотирьох структурних станах залежно від типу зв’язаного ліганду: 1) EF2·GTP поза рибосомою – має високу спорідненість до рибосоми; 2) EF2·GTP на рибосомі – активна GTP-аза; 3) EF2·GDP·Pi – після гідролізу GTP (Pi – неорганічний фосфат); 4) EF2·GDP після дисоціації фосфату – має низьку спорідненість до рибосоми.
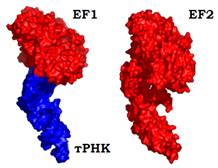
Рис. 24. Поверхня комплексу EF1-тРНК(структура з рис. 17) і білка EF2 (2EFG).
Вільний від будь-якого ліганду білок не має впливу на транслокацію, однак у комплексі з будь-яким гуаніновим нуклеотидом (включаючи також аналоги GTP, що не можуть бути гідролізовані) фактор прискорює транслокацію за рахунок своєї спорідненості до проміжного відкритого стану рибосоми. Проте у випадку гідролізу GTP (який передує остаточній транслокації) швидкість переміщення рибосоми підвищується ще в ~50 разів: найефективнішим стабілізатором відкритого стану рибосоми виявляється форма EF2·GDP·Pi.
Отже, сценарій транслокації можна уявити наступним чином (рис. 25).
• Після транспептидації рибосома перебуває в рівновазі між закритою та відкритою формою. Тільки друга форма здатна до транслокації, але вона у той самий час є більш високоенергетичною – рівновага зсунута в бік закритої форми.
• Взаємодія з EF2·GTP стабілізує відкриту форму рибосоми. Швидко після зв’язування, за рахунок взаємодії з сайтом G-білків у основі стебла L7/12, EF2 набуває GTP-азної активності – відбувається гідроліз GTP і перехід EF2 у структурну форму, що найефективніше сприяє розблокуванню рибосоми.
• У розблокованій формі рибосома рухається вздовж мРНК (зв’язок мРНК з молекулами тРНК зберігається, тобто вона переміщується також відносно тРНК). Цей рух є броунівським (одномірна дифузія під дією теплових флуктуацій), але спорідненість пептидил-тРНК до Р-сайта робить напрямок до 3′-кінця мРНК більш імовірним. Крім того, тРНК-подібний”структурний домен EF2 взаємодіє з маленькою субодиницею в межах А-сайта, сприяючи витісненню звідти антикодонової частини пептидил-тРНК.
• Одночасно з переміщенням, і незалежно від нього, відбувається дисоціація неорганічного фосфату. EF2, який залишається в комплексі з GDP, втрачаючи спорідненість, дисоціює від рибосоми, яка, у свою чергу, повертається до закритого структурного стану.
У результаті система є готовою до наступного елонгаційного циклу: новий кодон опинився в А-сайті, сам А-сайт є вільним від тРНК. Деаміноацильована тРНК, яка в результаті транслокації опинилася в Е-сайті рибосоми, може дисоціювати звідти відразу, або залишитися до етапу зв’язування наступної аа-тРНК.
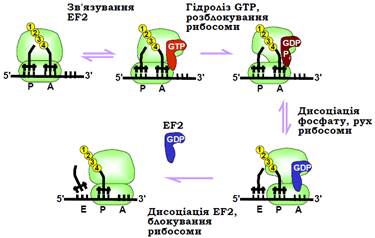
Рис. 25. Послідовність основних подій при транслокації рибосоми.
Описані механізми функціонування рибосоми під час елонгаційного циклу дозволяють стверджувати, що рибосома працює за принципами молекулярної машини – пристрою, який з високою швидкістю (у середньому 10 – 15 елонгаційних циклів за секунду) і точністю (частота помилок ~10–4) здійснює білковий синтез. Під час елонгаційного циклу рибосома осцилує між закритим структурним станом, який забезпечує каталіз реакції нарощування амінокислотного ланцюга, і відкритими станами, в яких здійснюється специфічний відбір амінокислот згідно з генетичним кодом та переміщення рибосоми вздовж матриці. Перемикання конформацій залежить від взаємодій з факторами елонгації, які фіксують проміжні відкриті стани рибосоми, забезпечуючи прискорення перебудов. Гідроліз двох молекул GTP під час елонгаційного циклу використовується для звільнення факторів і повернення рибосоми до закритої жорсткої конформації.
Рушійною силою для переміщення рибосоми та її частин є хаотичний тепловий рух, але молекулярна конструкція рибосоми, її взаємоді їз тРНК, матрицею та факторами елонгації, і зміни цих взаємодій унаслідок хімічних реакцій (транспептидація, гідроліз GTP) задають певну траєкторію рухів і каталізують їх у певних напрямах. Аналогічні механізми використовуються й при ініціації та термінації трансляції.
Дата добавления: 2015-09-11; просмотров: 916;
