Аміноацилювання тРНК
Порядок залучення амінокислот до поліпептидного ланцюга, що утворюється при білковому синтезі, залежить лише від взаємодій між нуклеїновими кислотами – кодоном і антикодоном; амінокислота, яку несе тРНК, жодним чином не розпізнається рибосомою. Отже, акцептування певної амінокислоти молекулою тРНК відповідного типу (і тільки відповідного) є одним із найважливіших моментів білкового синтезу: від точності процесу акцептування буде залежати й точність синтезу білка в цілому.
Процес приєднання амінокислот до тРНК каталізується аміноацил-тРНК-синтетазами (АРС-аза, aaRS – aminoacyl-tRN- Synthetase). Кожна з 20 типів (за кількістю амінокислот) цих ферментів каталізує дві хімічні реакції (рис. 3):
• На першій стадії відбувається так зване активування амінокислоти – її приєднання до АМР з утворенням аміноациладенілату, коли пірофосфат (рр) у складі АТР замінюється на амінокислоту (аа). Активування амінокислоти супроводжується зниженням вільної енергії, але при цьому значна частина вільної енергії, що звільняється при відщеплені пірофосфату від АТР, заощаджується у формі аміноациладенілату – молекули, гідроліз якої також супроводжується великим енергетичним ефектом. Молекула АТР, що використовується на етапі активування амінокислоти, – єдине джерело енергії для майбутнього синтезу пептидного зв’язку на рибосомі.
• Аміноациладенілат утворює проміжний комплекс з активним центром ферменту й ефективно атакує ОН-групу рибози 3′-кінцевого аденозину тРНК (3′- або 2′- ОН-групу залежно від класу АРС-ази): відбувається перенесення амінокислоти на тРНК. Після дисоціації від АРС-ази у складі аа-тРНК має місце спонтанний обмін амінокислоти між двома ОН-групами рибози; при зв’язуванні з рибосомою амінокислота фіксується на 3′ ОН-групі. Аа-тРНК – також макроергічна сполука: руйнування зв’язку між амінокислотою та тРНК є енергетично вигідним, що й забезпечує утворення пептидного зв’язку на рибосомі.
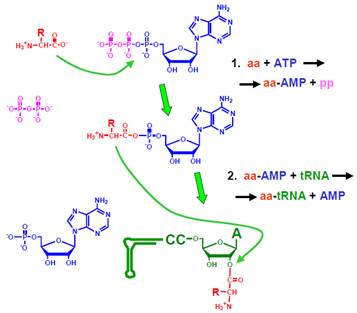
Рис. 3. Приєднання амінокислоти до тРНК, яке каталізується АРС-азою.
Отже, АРС-ази не тільки залучають амінокислоти до білкового синтезу, приєднуючи їх до тРНК, а й забезпечують заощадження вільної енергії, необхідної для приєднання амінокислоти до поліпептидного ланцюга. Двадцять типів АРС-аз, між якими немає майже нічого спільного на рівні первинної структури, можна поділити на два класи, по десять у кожному (табл. 2). Це завжди мультидоменні білки зі складною структурою (рис. 4), що зумовлено розмаїттям функцій – необхідністю специфічно зв’язати три субстрати й каталізувати дві хімічні реакції.
Крім того, еукаріотичні АРС-ази різних типів взаємодіють між собою та з мембраною ендоплазматичного ретикулуму, утворюючи так звану кодосому, що розташована поблизу від рибосом. Мультисубодиничні АРС-ази (гомодимери, гомотетрамери або гетеротетрамери) містять два ідентичні набори активних центрів та сайтів зв’язування.
Таблиця 2.
Дата добавления: 2015-09-11; просмотров: 1857;
