Комплекси ремоделювання хроматину
Підвищення доступності промоторів за їхньої активації потребує спеціальних механізмів. Адже за фізіологічної іонної сили електростатичні взаємодії ДНК і гістонів є дуже міцними, і нуклеосома зберігає високу стабільність. Ця стабільність практично виключає навіть переміщення нуклеосоми вздовж ДНК (слайдинг): таке переміщення потребує появи високоенергетичних інтермедіатів із частковим порушенням взаємодії гістонів із ДНК. Оскільки переміщення нуклеосом є необхідним для експонування регуляторних сайтів на ДНК до дії транскрипційних факторів, у клітині існує спеціальна система, що сприяє репозиціюванню нуклеосом за рахунок індукування проміжних структурних станів: АТР-залежні комплекси ремоделювання хроматину.
На сьогодні описано велику кількість таких комплексів у дріжджів, комах і ссавців. Усі комплекси ремоделювання (КР) – мультибілкові комплекси досить великої молекулярної ваги – містять у своєму складі субодиницю, що має АТР-азну активність. Власне АТР-азний домен є дуже подібним для усіх комплексів і має високу гомологію з ДНК-геліказами.
Залежно від наявності додаткових структурних доменів різного типу в складі каталітичної субодиниці, КР поділяють на три основні групи: 1) Swi/Snf (Switch/Sucrose nonfer menting – назва походить від першого описаного КР цієї родини, який було відкрито як групу мутацій дріжджів з певними біохімічними проявами) – комплекси складаються з 10 – 15 субодиниць, каталітична субодиниця містить бромодомен, під час дії комплексу спостерігаються різноманітні проміжні структурні форми нуклеусом; 2) ISWI (Imitation SWItch) – 4 – 5 субодиниць, індукують слайдинг нуклеосом без масштабних змін їхньої структури; 3) CHD (Chromodomain Helicase DNA binding) – містять хромодомен і гістондеацетилазу, тісно пов’язані з перебудовами хроматину в репресованих ділянках.
Крім того, є низка комплексів, що не вкладаються в цю класифікацію. КР здатні здійснювати численні взаємодії з нуклеосомною ДНК, гістоновими хвостами, специфічними та загальними факторами транскрипції, гістонацетилтрансферазами тощо. При взаємодії з нуклеосомою КР і нуклеосома чітко орієнтуються відносноодне одного: КР родини Swi/Snf оточують нуклеосому, зв’язуючи її всередині глибокої порожнини. Основний результат активності всіх комплексів ремоделювання – репозиціювання нуклеосом. Крім того, комплекси родини Swi/Snf можуть індукувати перенесення октамеру гістонів з однієї ділянки ДНК на іншу або з ДНК на проміжні акцептори пістонів; 4). Механізм дії комплексів ремоделювання базується на гомологі їз ДНК-геліказами. Незважаючи на це, АТР-азна субодиниця КР не здатна діяти як геліказа – розводити два ланцюги. Подібно до геліказ, комплекси ремоделювання, використовуючи енергію гідролізу АТР, пересуваються вздовж ДНК, але без її руйнування. Така транслокація має бути пов’язана з одночасним обертанням ферменту навколо подвійної спіралі або навпаки – прокручуванням спіралі через фермент. Оскільки КР при цьому зафіксований на нуклеосомі, тобто взаємне обертання комплексу й нуклеосоми є неможливим, рух комплексу в бік віднуклеосоми буде генерувати торсійну напругу (зміну твіста), штовхаючи додаткові витки подвійної спіралі всередину нуклеосомної ДНК – ДНК прокручується через КР (рис. 16). Такий сценарій роботи комплексів ремоделювання розглядається сьогодні як найбільш імовірний.
Напруга, яка створюється за рахунок транслокації комплексу ремоделювання, може трансформуватися в зміну твіста в межах кінцевої ділянки нуклеосомної ДНК. Локальна зміна твіста дифундує всередину нуклеосоми, результатом чого є прокручування подвійної спіралі по поверхні октамеру гістонів, тобто зміна його позиції (рис. 17). При такому механізмі переміщення шляхом твістингу (twisting) не повинно спостерігатися великих змін у структурі нуклеосоми під час її пересування. Саме це й характерно для комплексів ремоделювання типу ISWI.
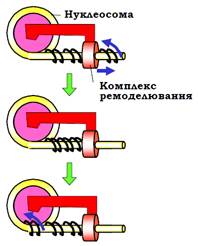
Рис. 16. Модель дії комплексу ремоделювання шляхом створення торсійної напруги в ДНК, яка входить у нуклеосому.
Комплекси ремоделювання родини Swi/Snf здатні генерувати проміжні стани нуклеосоми, в яких ДНК є більш доступною для нуклеаз, за рахунок формування петлі ДНК на поверхні октамеру гістонів.
Отже, на відміну від попереднього механізму, для комплексів Swi/Snf напруга, що є результатом транслокації, викликає випетлювання (bulging) нуклеосомної ДНК. Така петля, імовірно, формується на кінцевій ділянці ДНК у нуклеосомі й далі пересувається по поверхні октамеру, що приводить знову до зміни позиції нуклеосоми (рис. 17).
Проміжні метастабільні стани нуклеосоми з випетлюванням ДНК можуть відігравати важливу функціональну роль самі по собі, оскільки вже можуть забезпечувати зростання доступності нуклеосомної ДНК: експонування петлі створює умови для її захоплення транскрипційними факторами. Крім того, значна дестабілізація ДНК-гістонових взаємодій у проміжному стані з випетлюванням значно підвищує імовірність руйнування нуклеосоми: у присутності Swi / Snf продемонстровано перенесення гістонів на іншу ділянку ДНК або на проміжні переносники гістонів.
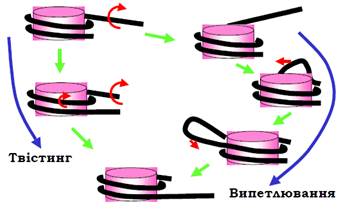
Рис. 17. Два механізми зміни трансляційної позиції нуклеосоми в результаті активності комплексів ремоделювання.
Обидва описані механізми дії комплексів ремоделювання розпочинаються з ділянки ДНК на вході до нуклеосоми. Відповідно, ця ділянка має бути вільною від гістону Н1: Н1 і КР конкурують між собою за зону входу / виходу нуклеосомної ДНК.
Шляхи рекрутування комплексів ремоделювання до промоторів. Насправді функціональні наслідки ремоделювання хроматину певним комплексом можуть бути різноманітними. Серед відомих нині комплексів ремоделювання лише один – NuRD (Nucleosome Remodeling and Deacetylation), представник родини CHD – працює виключно як корепресор. Дія інших комплексів ремоделювання призводить або до репресії, або до активації – залежно від контексту інших функціонально важливих впливів, у кооперації з якими працює даний комплекс.
У разі активації система АТР-залежного ремоделювання хроматину завжди працює кооперативно із системою ацетилювання гістонів. Реалізуються різноманітні стратегії рекрутування КР до промоторів:
• За рахунок взаємодії КР з транскрипційними факторами. Активація ініціюється ТФ, який упізнає невеликий сайт зв’язування на ДНК (навіть на поверхні нуклеосоми) і безпосередньо рекрутує комплекс ремоделювання, або КР рекрутується пізніше на стадії збирання енхансосоми іншими ТФ. Після цього, як правило, до енхансосоми рекрутується гістонацетилтрансферазний комплекс.
• За рахунок упізнання ацетильованих Lys бромодоменом, що входить до складу КР. Один із прикладів, який поєднує цей і попередній шляхи рекрутування КР, зображено на рис. 18: невеликий транскрипційний фактор зв’язується у промоторі й рекрутує гістонкіназу; кіназа здійснює фосфорилювання Ser10 гістону Н3 та дисоціює; фосфорильований Ser10 і транскрипційний фактор упізнаються гістонацетилтрансферазою, відбувається ацетилювання лізинів; ацетильовані Lys та ТФ рекрутують SWI/SNF (комплекс, що належить до родини Swi/Snf), який, здійснюючи репозиціювання нуклеосоми, звільняє ТАТА-бокс; відбувається зв’язування TFIID і збирання преініціаторного комплексу. Інший приклад див. на рис. 19.
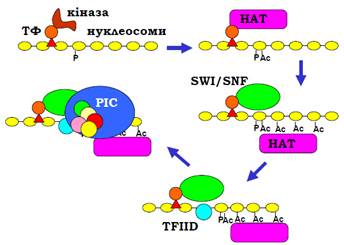
Рис. 18. Послідовність подій при активаціїдріжджового промотора INO1.
• За рахунок взаємодії з білками ядерного матрикс, які можуть рекрутувати комплекс ремоделювання до основи хроматинової петлі – до ділянок, асоційованих з матриксом (MAR). Така ділянка часто використовується як своєрідні вхідні ворота для факторів, що забезпечують регуляцію активності в межах петлі, де міститься один або кілька генів.
• За рахунок упізнання метильованих Lys хромодоменом, який входить до складу КР родини CHD. Комплекси цієї родини містять також структурні модулі, здатні впізнавати метильовані цитозини (5mC) у ДНК.
Таким чином, комплекси ремоделювання хроматину інкорпоровані в загальну систему регуляції транскрипції. Вони працюють у тісній кооперації з транскрипційними факторами та системою посттрансляційних модифікацій гістонів.
Дата добавления: 2015-09-11; просмотров: 1320;
