Елонгація РНК-полімерази через хроматин
Описані вище зміни у структурі хроматину стосуються ініціації транскрипції. На стадії елонгації нуклеосома також має створювати суттєві перешкоди для проходження РНК-полімерази. При цьому хроматин, навіть у межах активних генів, у цілому зберігає нуклеосомну структуру, хоча й спостерігається збіднення на гістон Н1.
В експериментах in vitro наявність нуклеосом у складі матриці значно гальмує транскрипцію. У той же час, швидкість транскрипції in vivo практично така сама, як in vitro на вільній ДНК. Отже, мають існувати особливі механізми, котрі забезпечують прозорість нуклеосом для РНК-полімерази у клітинному ядрі.
На модельній системі in vitro, що містила мономерну РНК-полімеразу бактеріофага SP6 і коротку (227 пар основ) ДНК-матрицю з однією позиційованою нуклеосомою, було показано, що гістоновий октамер переноситься як ціле на ділянку позаду полімерази (рис. 22). При цьому октамер ніколи не втрачає повністю свого контакту з ДНК: у процесі перенесення спостерігаються інтермедіати, які нагадують проміжні структури з петлею ДНК на поверхні октамеру при ремоделюванні нуклеосом (порівн. рис. 17 та 22).

Рис. 22. Проходження мономерної РНК-полімерази бактеріофага SP6 через нуклеосому.
За аналогічним механізмом із перенесенням октамеру здійснюється проходження через нуклеосому еукаріотичної РНК-полімерази ІІІ.
Що стосується РНК-полімерази ІІ, її проходження через хроматин супроводжується частковим руйнуванням нуклеосом попереду полімерази та відновленням їх позаду:
• В ядрах клітин спостерігається досить швидкий, транскрипційно-залежний обмін гістонів Н2А і Н2В між хроматином та ядерним пулом гістонів.
• Нуклеосоми, які транскрибуються РНК-полімеразою ІІ, тимчасово збіднені на гістони Н2А і Н2В.
• Видалення димеру гістонів Н2А Н2В РНК-полімеразою ІІ було продемонстровано на модельній системі in vitro.Узагалі, порівняно з РНК-полімеразами ІІІ і бактеріофага SP6, для РНК-полімерази ІІ нуклеосома є значно вагомішою перешкодою.
Із цього випливають два наслідки. По-перше, нуклеосомний бар’єр може використовуватися для регуляції експресії генів шляхом зниження швидкості елонгації за рахунок пауз у роботі полімерази на нуклеосомах. По-друге, наявність нуклеосомного бар’єра зумовлює необхідність спеціальних механізмів полегшення елонгації транскрипції.
Швидкість транскрипції всіх РНК-полімераз залежить від іонної сили: в умовах низької іонної сили нуклеосома гальмує проходження полімерази (SP6) або повністю зупиняє її (РНК-полімераза ІІ); підвищення іонної сили до рівня, трохи вищого за фізіологічний (наприклад, 300 ммоль/л), призводить до зростання швидкості транскрипції. Зрозуміло, що підвищення іонної сили знижує спорідненість гістонів до ДНК і тим самим певною мірою дестабілізує нуклеосому. Роль трошки підвищеної, у порівнянні з фізіологічною, іонної сили можуть відігравати in vivo фактори елонгації транскрипції, які працюють як проміжні переносники гістонів.
Описано кілька факторів елонгації, що прискорюють роботу РНК-полімерази ІІ:
• Elongator – мультибілковий комплекс, одна із субодиниць якого є гістонацетилтрансферазою. Комплекс взаємодіє з РНК-полімеразою ІІ і здійснює ацетилювання гістонів підчас елонгації транскрипції.
• FACT (FAcilitates Chromatin Transcription) – складається з двох субодиниць, одна з яких є HMGB-подібним білком. FACT має підвищену спорідненість до димерів гістонів Н2АН2В – виконує роль проміжного переносника димерів, забезпечуючи їх видалення з нуклеосом попереду полімерази та повернення до хроматину позаду.
• Spt6 – проміжний акцептор зі спорідненістю до гістонів Н3Н4.
У хроматині є також інші переносники гістонів. Крім того, АТР-залежні комплекси ремоделювання хроматину виконують роль факторів, що сприяють елонгації транскрипції. Проходження РНК-полімерази (як і будь-якого іншого ферменту, котрий здійснює транслокацію вздовж ДНК) за умов жорсткого закріплення кінців матриці (основ хроматинової петлі) має створювати позитивну надспіралізацію попереду та негативну – позаду полімеразного комплекс. Надспіралізація в процесі транскрипції виникає у зв’язку з тим, що обертальний рух РНК-полімеразного комплексу навкруг подвійної спіралі значно загальмований унаслідок масивності комплексу, у тому числі – присутності в його складі довгого ланцюга РНК, що синтезується. У результаті при трансляційному русі полімерази ДНК змушена обертатися навкруг своєї осі, що призводить до торсійного перекручування дуплекса попереду полімерази і, відповідно, еквівалентного розкручування – позаду.
Позитивна надспіралізація дестабілізує ліву суперспіраль нуклеосомної ДНК попереду полімерази, що сприяє дії проміжних переносників гістонів. І навпаки – негативна надспіралізація позаду полімерази сприяє ефективному відновленню нуклеосом.
Завдяки цим механізмам (які ще далеко не з’ясовані остаточно) в еукаріотичних клітинах здійснюється ефективна елонгація транскрипції при збереженні нуклеосомної структури навіть у транскрипційно-активних ділянках. Проте присутність нуклеосом залежить від рівня транскрипційної активності – кількості РНК-полімераз, що одночасно працюють на певному гені. Якщо ген є гіперактивним, ДНК може бути недоступною для гістонових комплексів, які залишаються на проміжних акцепторах (рис. 23).
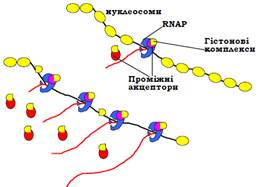
Рис. 23. Залежна від рівня активності транскрипції структура хроматину в транскрипційно-активних ділянках.
Дата добавления: 2015-09-11; просмотров: 1198;
