Механізми використання енергії гідролізу АТР
Джерелом енергії для всіх процесів, що її потребують, у живих системах є нуклеозидтрифосфати. Найчастіше використовується аденозинтрифосфат (adenosine triphosphate, ATP). Ця сполука, яка утворюється при перенесенні протонів через мембрану хлоропластів (фотосинтез) чи мітохондрій (окислювальне фосфорилювання), схематично показана на рис. 20.

Рис. 20. Гідроліз АТР.
Вона складається з азотистої основи (аденіну), пентозного цукру (рибози) та трьох залишків фосфорної кислоти. Гідроліз АТР приводить до відщеплення одного з них − залишається аденозиндифосфат (adenosine diphosphate, ADP) і неорганічний фосфат Рі (рис. 20).
Звичайно, як будь-яка інша реакція, гідроліз АТР потребує каталізу (за участю досить широкого класу ферментів – АТР-аз). Роль АТР як джерела енергії зумовлена тим, що ця реакція супроводжується досить великим зниженням вільної енергії. Зв’язок між фосфатними залишками, який руйнується при перетворенні АТР на ADP, іноді так і називають − макроергічним. Ця назва не має викликати помилкового уявлення, що цей зв’язок заощаджує надзвичайно велику енергію. По-перше, в цьому зв’язку немає нічого особливого. По-друге, загальна кількість ковалентних зв’язків не змінюється в ході реакції − фосфатний залишок переноситься на молекулу води (рис. 20). Змінюється тільки вільна енергія набору хімічних сполук, які зображені на рис. 20. Причому головний внесок у цю зміну дають концентраційні (тобто ентропійні) ефекти, а не хімічні перебудови молекул.
Скориставшись рівнянням (1.5), різницю вільних енергій продуктів і субстратів реакції, зображеної на рис. 20, можна записати як

де у квадратних дужках − молярні концентрації відповідних компонентів, ΔG* − стандартна зміна вільної енергії, RT = 0,6 ккал/моль. Оцінки показують, що величина ΔG* = +4,8 ккал/моль (тобто є позитивною − стандартна вільна енергія зростає). Проте, ця величина не має великого сенсу: енергетичний ефект реакції ΔG дорівнює ΔG* при концентраціях усіх компонентів 1 моль/л. Але концентрації води та протонів зберігаються постійними як у буферному розчині in vitro, так і в клітині; причому вони значно відрізняються від 1 моль/л (у розведеному розчині [H2O] = 55,5 моль/л, при рН 7,0[Н+] = 10-7 моль/л). Отже, відношення цих концентрацій − також постійна величина, і можна ввести іншу, більш змістовну, стандартну вільну енергію реакції

і записати
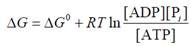
Підстановка значень концентрацій води й протонів даєΔG0 = −7,3 ккал/моль, що вказує на енергетичну вигідність реакції гідролізу. Головний внесок дає той факт, що в реакції народжується вільний протон: за законом діючих мас, підтримання на дуже низькому рівні загальної концентрації протонів має зсувати рівновагу в бік їхнього утворення.
Але в клітинах концентрації усіх компонентів, що залишилися в останньому рівнянні, також підтримуються на певних рівнях: 3÷8 ммоль/л АТР; 0,2÷1 ммоль/л ADP; 2÷8 ммоль/л неорганічного фосфату. Підстановка цих значень дає реальний енергетичний ефект відгідролізу АТР: ΔG = −12 ÷ −16 ккал/моль.
Ця енергія використовується двома шляхами: 1) для хімічної модифікації субстратів, які самі по собі не можуть вступити в певну реакцію (головним чином, маються на увазі реакції синтезу), оскільки вона супроводжувалась би зростанням вільної енергії; 2) для виконання механічної роботи молекулярними машинами.
Модифікація субстратів. Розглянемо хімічну реакцію
A+B ↔ C, ΔG > 0 .
Оскільки утворення С супроводжується зростанням вільної енергії, цей процес є неможливим. Типовий спосіб, яким жива система вирішує цю проблему, виглядає так: A+ATP ↔ AP+ADP, ΔG < 0
AP+B ↔ C+Pi , GΔ < 0.
Тут, власне, немає гідролізу АТР: відбувається перенесення фосфатного залишку на молекулу А (фосфорилювання). Реакція відбувається, оскільки супроводжується зниженням вільної енергії. Для розрахунку цієї величини можна скористатися енергіями гідролізу: щоб загальна вільна енергія реакції була негативною, енергія гідролізу АТР має бути вищою за абсолютною величиною, ніж енергія гідролізу сполуки АР, обидві величини негативні. Далі здійснюється друга енергетично вигідна реакція − утворення сполуки С з вилученням неорганічного фосфату − тут знову енергія гідролізу АР має бути вищою за абсолютною величиною, ніж (негативна) енергія гідролізу С. З певними модифікаціями (наприклад, часто переноситься не фосфат, а аденозинмонофосфат АМР) саме така схема використовується для здійснення хімічних реакцій синтезу, зокрема синтезу біополімерів.
Молекулярні машини − білкові молекули чи, частіше, макромолекулярні комплекси, утворені за участю білків, які здатні здійснювати спрямовані рухи. Робота таких машин забезпечує переміщення клітинних структур та органел (наприклад, розходження хромосом при клітинному поділі), зміну форми клітин, активне переміщення клітин, активний транспорт через мембрану проти градієнтів концентрації, м’язові скорочення, переміщення полімераз уздовж матриці при синтезі біополімерів тощо. Усе це потребує енергії, джерелом якої також є АТР (або інші нуклеозидтрифосфати).
Узагалі машина − це пристрій для перетворення тієї чи іншої форми енергії в рух. Звичайна механічна машина перетворює будь-яку енергію в механічну, умовою заощадження механічної енергії при цьому є висока інерція (маса) частин машини і певна їхня жорстка взаємна орієнтація. Точніше, конструкція машини зумовлює рухи її частин тільки по певних заданих траєкторіях.
Молекулярна машина, на відміну від макроскопічної механічної машини, по-перше, маленька, тобто піддається тепловому руху своїх власних частин і зовнішніх молекул, що робить неможливим заощадження механічної енергії. По-друге, вона побудована з полімерів, а це означає, що її частинам притаманна конформаційна рухливість. Проте внаслідок того, що молекула білка має певну досить жорстку просторову організацію, конструкція молекулярної машини допускає не будь-які, а певним чином спрямовані у просторі рухи її частин.
Саме ці особливості молекулярної машини й використовуються для її роботи. Основні принципи цієї роботи:
• Конформаційна рухливість молекулярної машини забезпечує їй можливість існувати в кількох структурних станах (двох-трьох), які розрізняються головним чином на рівні просторового розташування великих структурних блоків − доменів або субодиниць.
• Структурні стани мають різну спорідненість до певних лігандів. Взаємодії з лігандами (факторами) фіксують певні стани.
• Хімічні реакції, які каталізуються машиною, приводять до заміни лігандів, а відповідно − і до переходу в інший структурний стан.
• Рушійною силою для переміщення блоків є тепловий рух: блоки рухаються хаотично (хоча й у відповідності з конструкцією машини); зв’язування лігандів та заміна їх унаслідок реакцій каналізують ці рухи в певних напрямках.
• Результатом структурних перебудов є переміщення структурних блоків у просторі та / або зміна характеру взаємодії машини зі своїм оточенням − рух або всієї машини, або відносний рух її частин.
Загальний принцип перемикання структурних станів є точно таким, що його було зображено на рис. 17 − для фіксації станів використовується енергія зв’язування з лігандом. Як ліганд часто використовується саме АТР та продукти його гідролізу. Реакція гідролізу (тут відбувається саме гідроліз, як зображено на рис. 20) є просто засобом змінити ліганд − і перемкнути структурні стани. Вільна енергія гідролізу визначає ймовірність проходження реакції (див. рівняння (1.6)), а відповідно й імовірність перемикання конформацій білка.
Типовий елементарний «такт» роботи молекулярної машини зображено на рис. 21: структурна форма А зв’язує АТР з високою спорідненістю; спрацьовує АТР-азний каталітичний центр − ADP, що виникає внаслідок гідролізу, має підвищену спорідненість до форми В − відбувається структурна перебудова. Потім ADP витісняється новою молекулою АТР, і цикл повторюється.

Рис. 21. Схема роботи молекулярної машини. Праворуч: рівні вільної енергії структурних станів з різними лігандами.
Приблизно за такою схемою працює, наприклад, актоміозиновий комплекс у м’язових (і не тільки) клітинах (рис. 22). Міозиновий філамент складається з молекул міозину − великого білка досить складної структури. Від основи цього філаменту відходять глобулярні домени міозину − головки (показано лише одну). Головка має спорідненість до АТР і містить АТР-азний каталітичний центр.
Зв’язування АТР фіксує головку в структурному стані, який не має спорідненості до філаменту, що складається з молекул іншого білка − актину. Після гідролізу АТР нові ліганди − ADP і неорганічний фосфат − фіксують інший стан: головка зв’язується з актином, відхиляючись ліворуч. Третій стан головки індукується окремою молекулою ADP після дисоціації фосфату: зміщення головки праворуч без втрати зв’язку з актином.
У результаті актиновий філамент зсувається разом із головкою. Далі ADP витісняється новою молекулою АТР, і все повторюється. Актиновий філамент при дисоціації головки не повертається назад, оскільки фіксується іншими головками, що перебувають на інших стадіях свого робочого циклу.

Рис. 22. Спрощена схема роботи актоміозинового комплексу.
Дата добавления: 2015-09-11; просмотров: 1367;
