Конформаційна рухливість білків
У відповідь на екстремальні зовнішні впливи in vitro (наприклад, підвищення температури) глобулярний білок може втратити свою впорядковану структуру − стати денатурованим. Дослідження цього процесу є дуже важливим для з’ясування механізмів стабілізації структури білка. Але ще цікавішою є можливість зміни структурної форми за фізіологічних умов − саме в цьому сенсі будемо далі розуміти конформаційну рухливість білка.
Хоча нативна молекула білка − тверде тіло, вона є досить маленькою. Тобто, на відміну від макроскопічних твердих тіл, молекула білка знаходиться під дією теплового руху як частин власної молекули, так і оточуючих молекул. Невеличкі конформаційні зміни, перш за все зміни кутів обертання основного ланцюга та бокових залишків на перемичках між елементами вторинної структури, можуть зумовити тимчасових взаємних зсувів ділянок вторинної структури. Але якщо ці структурні блоки залучені до формування спільного (і щільного) гідрофобного ядра, взаємодія між ними швидко відновить вихідну конформацію (у випадку, коли немає додаткових факторів, що можуть порушити баланс вільної енергії). Ще більша рухливість притаманна мультидоменним і субодиничним білкам: окремі домени (субглобули) можуть деформуватися і, що більш важливо, рухатися відносно одинодного. Отже, в основі конформаційної рухливості білка лежить взаємний зсув великих структурних блоків (субодиниць, доменів або елементів вторинної структури) за рахунок невеликих локальних деформацій. Іноді відбуваються також локальні перебудови вторинної структури в різних структурних станах білка − руйнування або утворення спіралей тощо. Найрадикальнішою структурною зміною є утворення просторової структури у згаданих неструктурованих білках за умов їхньої взаємодії з іншими молекулами. Зрозуміло, що структурні перебудови змінюють форму робочої поверхні молекули, тобто впливають на виконання білком своїх функцій.
Припустимо, що організація білка дозволяє існування двох структурних станів − А і В. Загалом можливо, що обидва стани не розрізняються за величиною вільної енергії − тоді половину часу білок проводить в одному стані, другу − в іншому. Але, як правило, вільна енергія одного зі станів (наприклад, А) є нижчою, тоді конформаційна рівновага зсунута саме до нього (рис. 17, ліворуч).
Як можна перемкнути цю рівновагу на користь стану В (якщо, наприклад, саме він має виконувати якусь функцію)? Типовий шлях такого перемикання полягає у використанні певної сполуки (ліганду).
Як ліганд може виступати органічна низькомолекулярна сполука, іон, інший білок − залежно від конкретної системи. На рис. 17 показано ситуацію, коли ліганд має спорідненість саме до форми В і немає такої до форми А. Це означає, що вільна енергія знижується при зв’язуванні ліганду з формою В, але зростає при зв’язуванні з формою А, тобто зв’язування з А просто не відбувається. Головним є те,що у присутності ліганду здійснюється зміна балансу вільної енергії:стан В (точніше, комплекс BL) стає переважним − його вільна енергія є нижчою, ніж вільна енергія стану А.
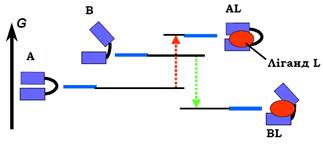
Рис. 17. Схема структурних переходів у молекулі білка, опосередкованих лігандом. G − шкала вільної енергії.
Результатом такої фіксації одного зі структурних станів за рахунок зв’язування з лігандом є зміна робочої поверхні білка. При цьому робоча поверхня часто розташована зовсім в іншому місці відносно ділянки зв’язування ліганду. Ліганд (або його відсутність) виступає лише сигналом, регулятором, який перемикає структурні, а відповідно, і функціональні стани. Регуляція такого типу отримала назву алостеричної регуляції (від άλλος − інший).
Дата добавления: 2015-09-11; просмотров: 1128;
