Експресія рекомбінантних білків
Оскільки переважна більшість білків синтезується клітиною в невеликих кількостях, просте виділення цих білків із метою їхнього дослідження є практично неможливим. Технології рекомбінантних ДНК вирішують це питання. Ген, що кодує даний білок, можна клонувати, вбудувати (наприклад, у бактеріальну плазміду) і змусити бактеріальну культуру продукувати цей білок. Виділення та очищення білка з культури біохімічними методами вже не є принциповою проблемою, зважаючи на його велику кількість.
Одну з найпростіших схем експресії білка в E. сoli зображено на рис. 9. Зрозуміло, що еукаріотичний ген не має сенсу вводити в прокаріотичну клітину – прокаріоти не мають системи сплайсингу. Тому беруть лише кодуючу частину гена, яку можна отримати з бібліотеки клонів кДНК. Використовуючи придатну рестриктазу та лігазу, потрібну кДНК вбудовують у плазміду поряд із промотором – наприклад, лактозного оперона. Здійснюють трансформацію рекомбінантної плазміди в бактеріальні клітини, до бактеріальної культури додають синтетичний індуктор lac-оперона IPTG. Промотор активується, і здійснюється транскрипція гена та трансляція білка.
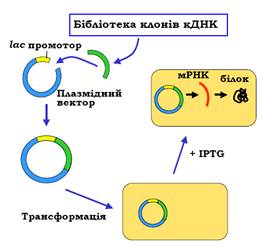
Рис. 9. Експресія білка в бактеріальній клітині. lac-промотор – промотор лактозного оперона, IPTG – синтетичний індуктор оперона.
Більш ефективна двостадійна система експресії використовує промотор РНК-полімерази бактеріофага Т7. У бактеріальному геномі ні таких полімераз, ні відповідних промоторів немає. У клітину вводяться два плазмідні вектори: один містить lac-промотор і ген РНК-полімерази Т7, інший – сильний промотор полімерази Т7 разом із геном білка, що має бути експресований. IPTG індукує експресію полімерази, яка зв’язується тільки з промотором у складі другої плазміди (інших промоторів немає) і забезпечує синтез великої кількості білка.
Вивчення структури й особливостей функціонування багатьох білків було б просто неможливим без такої штучної експресії. Крім того, використання рекомбінантних ДНК для експресії білків відкриває принципово нові можливості: послідовність ДНК можна практично як завгодно змінити й отримати мутантну форму білка. До білкового гена можна пришити ген іншого білка, який буде виконувати роль мітки. Частину гена, що відповідає частині білка (скажімо, структурному домену) можна вилучити, й отримати редукований білок чи окремий домен для структурних досліджень. Будь-який нуклеотид можна замінити на інший методами спрямованого мутагенезу, завдяки чому отримати білок з амінокислотною заміною. Такі підходи мають велике значення для вивчення механізмів активності ферментів, специфічного впізнання білками інших молекул тощо.
Одну з можливостей замінити нуклеотид за допомогою ПЛР ілюструє рис. 10. Як матриця для ампліфікації використовується плазміда, котра містить послідовність мішень. Реакція проводиться у двох варіантах – із різними наборами праймерів. Один із двох праймерів у кожному наборі містить замінений нуклеотид, як показано на рисунку. Результатом ампліфікації є лінійні молекули ДНК із заміненою нуклеотидною парою. Об’єднання продуктів ампліфікації, денатурація і потім ренатурація приводять до того, що половина молекул обмінюється ланцюгами: оскільки дволанцюговий розрив має різне положення у продуктах ампліфікації, утворюються дві циркулярні молекули з одноланцюговими розривами. Після трансформації в бактеріальну клітину лінійні молекули (друга половина матеріалу) руйнуються бактеріальними нуклеазами, а одноланцюгові розриви в циркулярних молекулах репаруються. У результаті відбувається клонування послідовності мішені, яка містить замінену нуклеотидну пару.
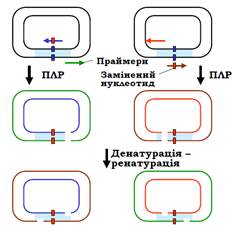
Рис. 10. Спрямований мутагенез за допомогою ПЛР.
Послідовність мішень зафарбована блакитним кольором.
Велика кількість білків (у тому числі, ферменти, що використовуються в рекомбінантних технологіях) виробляються шляхом експресії в бактеріальних клітинах. Поряд із прокаріотичними розробляються й використовуються також системи експресії рекомбінантних білків в еукаріотичних клітинах. Особливо важливими еукаріотичні системи експресії є для еукаріотичних білків, котрі не можуть бути синтезовані бактеріальною клітиною в активній формі. Це, зокрема, стосується білків, які піддаються суттєвим посттрансляційним модифікаціям – наприклад, глікопротеїдів.
Дата добавления: 2015-09-11; просмотров: 1530;
