Блот-гібридизація
Саузерн-блотинг. Потужним засобом аналізу складних сумішей ДНК щодо наявності там специфічних елементів послідовності є блот-гібридизація на нітроцелюлозних фільтрах за Саузерном (Edward Southern). Назва процедури, яку схематично зображено на рис. 11, походить від слова blotting (промакування): фрагменти ДНК розділюються за допомогою гель-електрофорезу (залишаючись невидимими в гелі), після чого на гель накладають нітроцелюлозний фільтр, а під та над цим «сендвічем» розміщують фільтрувальний папір і занурюють нижній шар паперу в лужний розчин. Під дією капілярних сил розчин піднімається до верхнього шару паперу, «захоплюючи» при цьому ДНК і переносячи її з гелю на нітроцелюлозу. Одночасно при цьому ДНК денатурується лугом. У результаті одноланцюгова ДНК опиняється на фільтрі – середовищі, придатному для подальшої гібридизації, а сам фільтр є точною реплікою вихідного гелю. Так само можна перенести ДНК на нітроцелюлозу, застосувавши електрофорез у поперечному напрямку – із гелю на фільтр. Далі проводять обробку фільтра зондом – одноланцюговим фрагментом ДНК певної послідовності, який містить радіоактивну мітку. Зонд гібридизується з комплементарною ДНК у певних досі невидимих смугах, що можна зафіксувати за допомогою авторадіографії.
У такий спосіб можна встановити, наприклад, наявність у геномі додаткових копій послідовності, що є гомологічними вже відомій; присутність у невивченому геномі генів, гомологічних відомим генам; присутність специфічних послідовностей ДНК у препаратах, що отримані з білковонуклеїнових комплексів. Прикладом одного з численних застосувань Саузерн-блотингу є метод фингерпринтингу ДНК (DNA fingerprinting).
Метод базується на факті наявності в еукаріотичних геномах мінісателітних повторів – невеликих елементів послідовності, що тандемно повторюються в різних місцях геному кілька разів. Розподіл локусів за кількістю повторів є індивідуальним – так само, як відбитки пальців. З метою ідентифікації особини (чи особи у криміналістиці, судових справах тощо) геномну ДНК обробляють рестриктазою, що не має своїх сайтів усередині повтору. Фрагменти розділяються шляхом електрофорезу, здійснюється блотинг і гібридизація з радіоактивно-міченим елементом послідовності мінісателіта. У результаті на авторадіограмі представлено специфічний для особини набір фрагментів різної довжини, тобто різної кількості повторів мінісателіта – своєрідний молекулярний відбиток (DNA fingerprint).
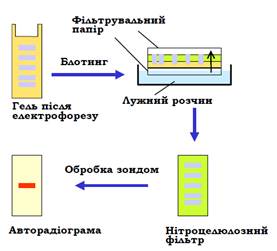
Рис. 11. Блотгібридизація.
Нозерн-блотинг відрізняється від описаної процедури блотингу за Саузерном лише тим, що на гель для електрофорезу наносять сумарний препарат виділеної мРНК. Гібридизація з міченим фрагментом ДНК (наприклад, кДНК із бібліотеки клонів) дозволяє встановити наявність певної мРНК, тобто активність гена, у клітинах певного типу, після дії активуючих/репресуючих факторів тощо, а також оцінити рівень цієї активності (концентрацію мРНК) за інтенсивністю забарвлення смуги на авторадіограмі. Назва методу (nothern) є просто жартівливою аналогією з буквальним значенням прізвища Саузерна.
Вестерн-блотинг – назва, що продовжує цю аналогію – це метод перенесення білків з гелю після електрофорезу на фільтр з метою аналізу складних білкових сумішей. Фільтр обробляють антитілами, специфічними до певного білка, потім міченими (наприклад, флуоресцентною міткою) антитілами до цих антитіл. Практично, це єдиний спосіб детектувати наявність малої кількості конкретного білка в тотальному білковому препараті.
Визначення стартових і кінцевих точок та рівня активності транскрипції.
Кілька описаних нижче прикладів ілюструють деякі підходи, розроблені для характеристики транскриптів і дослідження рівня транскрипційної активності.
Картування за допомогою нуклеази S1 дозволяє не тільки визначати старт і кінцеву точку транскрипції певного гена, а й оцінювати рівень транскрипційної активності цього гена. Процес починається з клонованого фрагмента гена, який містить кінцеву точку, яка має бути встановленою. Навкруг неї обирають два рестриктні сайти однієї рестриктази, і ще один – іншої, як показано на рис. 12.
Перша рестриктаза вирізає фрагмент, залишаючи одно ланцюгові вирости на 5′-кінцях. Використовуючи їх як матрицю, фрагмент Кленова ДНК-полімерази І добудовує 3′-кінці, приєднуючи радіоактивно мічені нуклеотиди – у результаті 3′-кінці обох ланцюгів містять мітку. Щоб позбавитись однієї з них, використовують сайт другої рестриктази, який все ще залишається всередині. Нарешті маємо мітку на 3′-кінці тільки матричного ланцюга (який із ланцюгів є матричним, треба знати при підборі рестриктаз або встановити за кінцевим результатом). Денатурація цього фрагмента дає радіоактивномічений одноланцюговий зонд, для якого є точно відомими його довжина й локалізація в гені. На останніх етапах проводять гібридизацію цього зонда із сумарним препаратом клітинної РНК у розчині – комплементарна частина відповідної мРНК утворює із зондом подвійну спіраль. Після цього й використовують нуклеазу S1, яка здатна гідролізувати тільки одноланцюгову нуклеїнову кислоту. Для локалізації кінцевої точки транскрипції залишається визначити точну довжину отриманого міченого фрагмента ДНК за допомогою електрофорезу: ця довжина дорівнює відстані від мітки до кінцевої точки. Інтенсивність смуги після електрофорезу дає інформацію про транскрипційну активність гена: чим вищою є інтенсивність, тим більше мРНК містилося у препараті, виділеному із клітини.
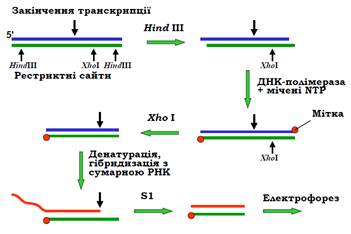
Рис. 12. S1-картування точки закінчення транскрипції.
Так само, підібравши інші рестриктази та здійснивши на відповідному етапі мічення 5′-кінців, можна визначити стартову точку транскрипції.
Подовження праймера (primer extension) – альтернативний метод визначення стартової точки. Для його реалізації необхідно знати будь-яку невелику послідовність усередині кодуючої частини гена й синтезувати відповідний праймер, помітивши його (рис. 13). Праймер додається до сумарної мРНК і гібридизується з нею, після чого здійснюється реакція зворотної транскрипції. Синтез ДНК зворотною транскриптазою припиняється на 5′-кінці мРНК, який і відповідає стартовій точці. Електрофорез у денатуруючих умовах дозволяє точно встановити довжину фрагмента, тобто локалізувати стартову точку відносно місця гібридизації праймера. Як і у випадку S1-картування, інтенсивність електрофоретичної смуги дозволяє оцінити кількість мРНК у препараті, тобто рівень транскрипційної активності.
Визначення транскрипційної активності in vivo. Описані методи визначають рівень присутності мРНК певного типу в клітині. Цей рівень залежить не тільки від рівня транскрипційної активності, але й від швидкості деградації мРНК. Один із методів, який дозволяє встановити, чи відбувається транскрипція в даний момент, полягає в тому, що клітинні ядра виділяються і до них додаються мічені нуклеозидтрифосфати. Нові акти ініціації транскрипції вже не відбуваються в таких відокремлених ядрах, і РНК-полімераза просто продовжує добудовувати транскрипти, синтез яких розпочався до виділення. Зрозуміло, що такі подовжені транскрипти виявляються міченими. Після виділення РНК їх треба ідентифікувати, що можна зробити шляхом гібридизації з ДНК генів, які цікавлять дослідника.
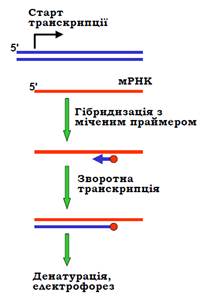
Рис. 11.13. Метод подовження праймера для визначення старту транскрипції.
Дата добавления: 2015-09-11; просмотров: 2164;
