Структурна класифікація глобулярних білків
Оскільки глобула будується з елементів регулярної вторинної структури, яких є всього два, цілком природно розділити структурні домени глобулярних білків на три групи: α-спіральні, β-структурні та змішаного типу. Виявляється, що кількість типів взаємної упаковки сегментів вторинної структури − так званих структурних мотивів, або типів укладки (fold), які забезпечують утворення гідрофобного ядра, −– досить обмежене.
α-Спіральні білки. Серед структурних мотивів, які складаються тільки з α-спіралей, в основному зустрічаються всього два типи. Довгі спіралі (довжиною до 5 − 6 витків) формують α-спіральні пучки (α-helix bundles). Дві (рідше три) спіралі у складі пучка утворюють шар з гідрофобною поверхнею, два такі шари, укладаючись паралельно (під кутом ~ 20°) або ортгонально (~ 90°), формують гідрофобне ядро (рис. 9).
Слід зробити наступні важливі зауваження щодо представлених структур: усі вони не мають гомології між собою щодо амінокислотної послідовності; білки подібної структури (гемеритрин і білок вірусу тютюнової мозаїки) виконують різні функції; білки різної структури (гемеритрин і міоглобін) виконують подібну функцію зв’язування оксигену.
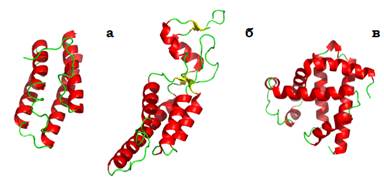
Рис. 9. Спіральні пучки з паралельною (а, б) чи ортогональною (в) упаковкою в гемеритрині (а, 1HMD), у білку оболонки вірусу тютюнової мозаїки (б, 1EI7), у міоглобіні (в, 1A6M).
Другим, більш розповсюдженим, структурним мотивом є упаковка трьох або більше α-спіралей у приблизно сферичну глобулу. Така упаковка реалізується для коротких спіралей, які значно частіше зустрічаються в білках (близько 10 − 12 залишків, тобто 3 − 3,5 витка). Приклади наведено на рис. 10 (подібна упаковка реалізується також для трьох α-спіралей, зображених на рис. 7). Короткі спіралі в цьому випадку розташовані по ребрах квазісферичного багатогранника, оточуючи приблизно сферичне гідрофобне ядро.
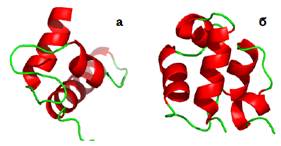
Рис. 10. Домени актинідину (а, 1AEC) і білка Cro бактеріофага 434 (б, 3CRO).
Указані структурні мотиви зустрічаються найчастіше, оскільки вони найкраще відповідають уже сформульованим вище двом правилам структурної організації білків. Крім того, розглядаючи ці структури можна сформулювати ще одне правило 3. Перемички між сегментами вторинної структури уникають взаємного перехрестя − суміжні по ланцюгу перемички розташовані по різні боки глобули. Таке перехрестя привело б або до контакту між перемичками (тобто їхньої дегідратації), або до значного вигину однієї з перемичок.
Обидва наслідки є енергетично невигідними. Інакше кажучи, украй мало можна уявити фрагментів амінокислотної послідовності, які б могли перетнутися без суттєвих енергетичних витрат.
Крім того, описані α-спіральні мотиви найкраще забезпечують вимогу щільної упаковки глобули − саме за цих типів взаємної орієнтації спіралей їхні поверхні можуть здійснити найбільшу кількість вандерваальсових контактів між собою.
β-Структурні білки. Основою β-структурних доменів є антипаралельні β-шари. Два шари β-структури, взаємодіючи своїми гідрофобними поверхнями, укладаються один на одного у своєрідний штабель, β-тяжі двох шарів орієнтуються при цьому паралельно або перпендикулярно (ортогональна упаковка) один до одного.
При ортогональній упаковці, унаслідок скрученості β-шарів, форма такого штабеля нагадує циліндр зі значним нахилом тяжів до осі (рис. 11). Ця укладка так і називається – β-циліндр, або β-діжка (β-barrel). Проекція ходу ланцюга на площину для такого структурного мотиву виглядає дуже просто: сусідні по ланцюгу ділянки є також сусідами у складі шару, і проекція еквівалентна візерунку меандр (часто зустрічається на античних амфорах).
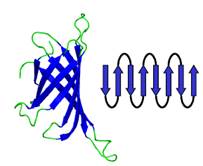
Рис. 11. β-Циліндр у стрептовідині (1HQQ); праворуч − проекція ходу ланцюга на площину, яка відповідає візерунку меандр.
Інший тип ходу ланцюга нагадує візерунок − грецький ключ (рис. 12), відповідна укладка являє собою два паралельні шари β-структури (β-сендвіч).
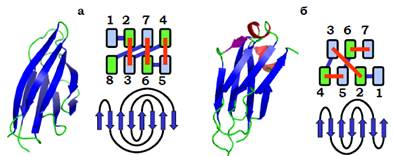
Рис. 12. (a) − Ксиланзв’язувальний домен ксиланази (1E5B); (б) − імуноглобулінова укладка в константному домені важкого ланцюга імуноглобуліну (15C8). Праворуч показано схеми упаковки двох шарів із торця (β-тяжі пронумеровані, блакитний − N, зелений – С-кінець фрагмента) і проекції ходу ланцюга на площину (для структури (б) короткі α-спіралі та один β-тяж, які прикривають торець, на схемах не показано).
Наведені приклади укладання β-структурних доменів з певними варіаціями зустрічаються дуже часто в глобулярних білках, оскільки найкраще відповідають правилам структурної організації білків і вимозі щільної упаковки глобули.
α/β-Білки. Так позначаються білки, в яких α-спіралі та β-тяжі регулярно чергуються по ланцюгу (відповідно, β-структура є паралельною, і α-спіралі також паралельні одна до одної). Для них найхарактернішими є два типи укладок (рис. 13): 1) α/β-циліндр − закручений у циліндр паралельний β-шар, оточений циліндром з α-спіралей; відповідно, утворюються два гідрофобні ядра − усередині β-циліндра та на інтерфейсі між β-структурою та α-спіралями; 2) укладка Россманна (Michael Rossmann) приблизно планарний шар паралельної β-структури, прикритий двома шарами α-спіралей; тут також утворюються два гідрофобні ядра на інтерфейсах між β-структурою та α-спіралями.
(α+β) Білки − білки з нерегулярним чергуванням α-спіралей і β-структурних тяжів. В їхньому складі два типи вторинної структури можуть бути рознесені: наприклад, β-сендвіч, торці якого прикриті α-спіралями чи α-спіральним субдоменом (рис. 14, а) – OB-укладка (oligonucleotide binding) із розташуванням елементів вторинної структури по ланцюгу ββββαββαβα. Іншим варіантом є так звана αβ-складка (αβ-plait), зображена на рис. 14, б: шар антипаралельної β-структури, гідрофобна поверхня якого закрита α-спіралями, розташування елементів вторинної структури по ланцюгу − βαββαβ.
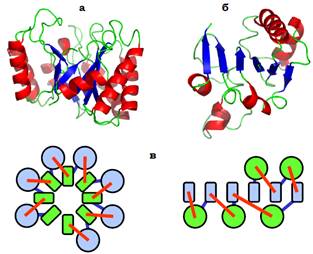
Рис. 13. (a) − α/β-циліндр ендоглюканази (1A3H);(б) − укладка Россманна в трансгідрогеназі (1D4O).(в) − відповідні схеми укладок з торця α-спіралей і β-тяжів.
Отже, як і для α/β-білків, у складі єдиної глобули, утвореної шарами сегментів вторинної структури, α-спіралі та β-структура завжди розділяються в різні шари. Занурення α-спіралі в шар β-структури привело б до зруйнування системи водневих зв’язків між β-тяжами.
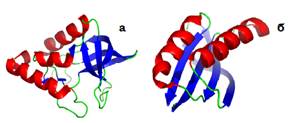
Рис. 14. (а) − стафілококова нуклеаза (1EY0);(б) − рибосомний білок S6 (1J5E).
Вище було розглянуто деякі найтиповіші структурні мотиви, що зустрічаються у глобулярних білках. Насправді, таких мотивів (укладок) нараховують дещо більше 100. Зрозуміло, що білки з гомологічною первинною структурою мають подібну просторову організацію. Але й десятки тисяч білків без гомології вписуються в досить обмежену кількість стандартних структурних мотивів. Причиною цього нетривіального спостереження є те, що стандартні мотиви найкраще відповідають певним правилам (частина яких сформульована вище) структурної організації, правилам, які випливають просто із загальних фізичних міркувань. У принципі, можна уявити порушення будь-якого із цих правил. Наприклад, можна так спроектувати амінокислотну послідовність, щоб гідрофобна перемичка між сегментами вторинної структури занурювалась у гідрофобне ядро з утворенням там водневих зв’язків її пептидними групами. Але зрозуміло, що для цього потрібен дуже обізнаний дизайнер. Сам факт наявності стандартних укладок свідчить про те, що за своїм походженням молекули білків є статистичними (випадковими) сополімерами 20 амінокислот.
І чим більше послідовностей може бути вписано в певну стандартну архітектуру глобули без порушення її стабільності, тим частіше така архітектура спостерігається у природі.
Це не означає, що будь-який статистичний сополімер амінокислот може сформувати стабільну глобулу. У результаті еволюційного відбору залишились лише ті сополімери (дуже невелика кількість), які допускають утворення стабільного, щільно упакованого (з великою кількістю вандерваальсових контактів) гідрофобного ядра. Слід зауважити, що вимога утворення гідрофобного ядра не означає, що всі неполярні залишки мають опинитися всередині (див. рис. 7, (б), (г)): наприклад, у середньому для всіх білків тільки 80 − 85 % залишків Leu занурюються у гідрофобне ядро, решта, які залишаються на поверхні, не впливають суттєво на стабільність глобул. І це є ще одним підтвердженням випадковості білкових послідовностей.
Отже, сучасні білки є випадковими полімерами амінокислот, спочатку відібраними за критерієм стабільності їхньої глобулярної структури, а потім відредагованими відбором − шляхом обмеженої кількості амінокислотних замін у двох напрямках: підвищення стабільності просторової структури та утворення активного центру, який має виконувати певну функцію. У результаті білки з різними функціями часто мають подібну просторову будову. І навпаки, білки, що виконують подібні функції, можуть бути зовсім різними за структурою.
На рис. 15 зображено дві серинові протеази (однакова функція), які належать до різних структурних типів, але містять однаково організований активний центр. Таким чином, для функціонування часто важливою є не стільки просторова структура білка, скільки сам факт її наявності: жорсткий каркас глобули утримує активний центр у певній просторовій конфігурації, не дозволяючи йому рухатися під дією теплових флуктуацій.
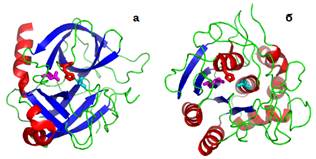
Рис. 2.15. (а) – α-хімотрипсин (4CHA); (б) − субтилізин (1SBC). Для кожного білка показані три залишки (Asp, His, Ser), які формують активний центр цих протеаз.
Дата добавления: 2015-09-11; просмотров: 1687;
