Робота № 4/5. Дослідження хімічної рівноваги в реакції термічного розкладу карбонату кальцію
Мета роботи.Дослідження хімічної рівноваги гетерогенної реакції й визначення залежності константи рівноваги від температури. Проведення термодинамічних розрахунків за експериментальними та довідниковими даними.
Методика роботи.За підвищених температур карбонат кальціюдисоціює за рівнянням  .
.
Константа рівноваги реакції дорівнює тискові СО2, 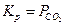
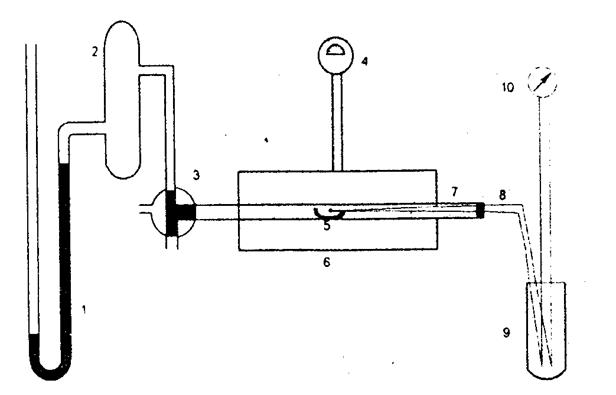
Порядок роботи. Робота виконується за допомогою пристрою, схему якого наведено на рис. 1. Фарфоровий човник 5 з наважкою карбонату вміщується до кварцового реактора 7, що знаходиться всередині печі 6. Піч має ступеневпй регулятор нагріву 4. Температура вимірюється термопарою 8, з'єднаною з потенціометром 10. Холодні паї термопари знаходяться за температури 0°С. Тиск у реакторі вимірюється манометром 1 відкритого типу.
Послідовність виконання роботи. Помістити в реактор човник з карбонатом. Повільно розігріти піч до 600°С за відкритого реактора, при цьому відбувається видалення з карбонату вологи і адсорбованих газів. Після цього щільно закрити реактор гумовим корком, через який пропущено термопару, і за допомогою форвакуумного насоса вакуумувати реактор. Виміряти залишковий тиск у реакторі Р0 за допомогою манометра 1.
|
| Рис. 1. Схема пристрою для вивчення рівноваги в реакції розкладу карбонату кальцію: 1 - манометр; 2 - пастка; 3 - кран; 4 - регулятор нагріву; 5 - човник із зразком карбонату кальцію; 6 - піч; 7 - кварцовий реактор; 8 -термопара; 9 - холодні паї термопари; 10 - потенціометр |
Вимірювання тиску CO2проводити в інтервалі температур 650 - 950°С. Для цього після досягнення температури дещо нижчої, ніж 650°С, піч вимкнути. Завдяки інерції температура в човнику продовжує підвищуватись протягом деякого часу і після припинення нагріву. Записати максимальну температуру, показану потенціометром, і максимальний тиск за манометром Рi. Коли вимірювання проведено, піч знову увімкнути.
Кожне наступне вимірювання проводити через 10-20°С. Якщо нагрівання печі здійснюється дуже повільно, вимірювання тиску CO2 можна проводити при безперервному нагріванні. Але оскільки хімічна рівновага при зростанні температури встановлюється не відразу, результати вимірювання тиску CO2 виявляються дещо заниженими. При зменшенні швидкості нагрівання печі зменшується різниця між вимірюваним тиском і рівноважним. Величиною, що безпосередньо визначається на манометрі, є різниця рівнів ртуті Dh. Тоді залишковий тиск в реакторі відразу після вакуумування за 600°С дорівнює
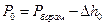 , (1)
, (1)
де Рбаром - атмосферний тиск у лабораторії. Вимірюваний тиск за більш високих температур дорівнює
 (2)
(2)
Різниця між Рi і Ро приблизно відповідає тискові CO2:
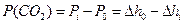 , (3)
, (3)
Результати вимірювань занести в таблицю за формою
| № | t, 0C | Dh | P(CO2) | 103/(t+273) | lnP(CO2) | x | y | x2 | xy |
Обробка одержаних результатів.Залежність константи хімічної рівноваги від температури для невеликого інтервалу температур описується рівнянням
 (4)
(4)
(це рівнянняодержується інтегруванням ізобари за умови  ) Рівняння (4) показує, що логарифм рівноважного тиску є лінійною функцією оберненої температури:
) Рівняння (4) показує, що логарифм рівноважного тиску є лінійною функцією оберненої температури:
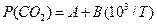 (5)
(5)
Обробка результатів експерименту полягає в знаходженні значень коефіцієнтів А і В та в розрахунку термодинамічних характеристик реакції. Коефіцієнти А і В знаходять за методом найменших квадратів, який для залежності
 (6)
(6)
дає формули:

 (7)
(7)
Якщо прийняти, що  і
і  , то розрахунки за формулами (7) необхідно проводити з великою точністю, не допускаючи округлення проміжних величин, інакше похибки округлення накопичуються і стануть настільки великими, що знайдені коефіцієнти а і b можуть виявитися неправильними. Необхідна точність досягається при проведенні розрахунків на комп'ютерах (калькуляторах) з використанням відповідних програм. Якщо ж немає можливості скористатися програмованим розрахунком, то розв'язати вказану вище проблему можна, перейшовши на нові змінні, а саме:
, то розрахунки за формулами (7) необхідно проводити з великою точністю, не допускаючи округлення проміжних величин, інакше похибки округлення накопичуються і стануть настільки великими, що знайдені коефіцієнти а і b можуть виявитися неправильними. Необхідна точність досягається при проведенні розрахунків на комп'ютерах (калькуляторах) з використанням відповідних програм. Якщо ж немає можливості скористатися програмованим розрахунком, то розв'язати вказану вище проблему можна, перейшовши на нові змінні, а саме:
 ;
;
 , (8)
, (8)
де a і b - сталі числа, за величинами близькі до експериментальних значень 103/Т і lnP відповідно. За використання таких змінних знайдені за формулами (7) коефіцієнти а і b будуть відповідати залежності:
 (9)
(9)
або
 (10)
(10)
Порівнюючи рівняння (5) і (10), бачимо, що
 ;
;
 (11)
(11)
Сталі числа a і b обираються довільно в межах інтервалів значень 103/Т і lnP. Зокрема, за a можна взяти середнє арифметичне усіх значень 103/T, а за b - середнє арифметичне усіх значень lnP. У цьому разі 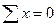 і
і 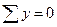 , внаслідок чого рівняння (7) істотно спрощуються, перетворюючись на
, внаслідок чого рівняння (7) істотно спрощуються, перетворюючись на
 ;
;
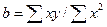 (12)
(12)
і відповідно до формули (11) переходять у
 ;
;
 (13)
(13)
У будь-якому разі після знаходження коефіцієнтів А і В необхідно перевірити їх правильність. Для цього треба за рівнянням (5), використовуючи знайдені значення А і В і температури досліду, розрахувати (lnP)розр і порівняти їх з експериментальними величинами (lnP)єксп для тих самих температур. Розраховані дані, звичайно, не повинні збігатися з експериментальними, але за правильних А і В кількість відхилень розрахованих lnP у більший бік повинна приблизно дорівнювати кількості відхилень у менший бік.
Перевірку можна зробити і по-іншому. На графік у координатах lnP - 103/Т нанести експериментальні точки і дві точки, розраховані за рівнянням (5), так, щоб вони знаходились на осяхкоординат. Через розраховані точки провести пряму лінію. Ознакою правильності коефіцієнтів А і В буде проходження лінії через сукупність експериментальних точок таким чином, щоб їх кількість по обидва боки від лінії була приблизно однаковою.
У разі позитивних результатів перевірки А і В розрахувати термодинамічні характеристики реакції:
а) ентальпію реакції (тепловий ефект) DH. З порівняння формул (4) і (5) видно, що
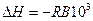 ; (14)
; (14)
б) вільну енергію Гіббса реакції -DG0T. Стандартне значення вільної енергії Гіббса пов'язано з константою рівноваги рівнянням
 (15)
(15)
Стандартними є ті значення, що відповідають тискові в 1 атм. Тому рівноважний тиск  у рівнянні (15) має бути виражено в атмосферах. Для переходу на атмосфери тиск у мм. рт. ст. треба поділити на 760. Тоді рівняння (5) перетвориться на таке:
у рівнянні (15) має бути виражено в атмосферах. Для переходу на атмосфери тиск у мм. рт. ст. треба поділити на 760. Тоді рівняння (5) перетвориться на таке:
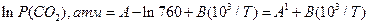 (16)
(16)
Підставивши ці значення в (15), одержимо:
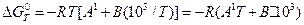 ; (17)
; (17)
в) ентропію реакції DS0T. Скориставшись рівнянням Гіббса -Гельмгольця і підставивши в нього значення DH і DG0T за рівняннями (14) і (17) отримаємо:
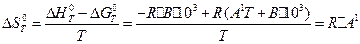 (18)
(18)
Ці самі термодинамічні характеристики реакції розрахувати за літературними даними.
1) 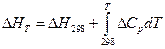 ;
;
2) 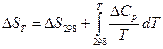 ;
;
3) 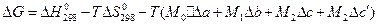 .
.
Можливі й інші варіанти теоретичного розрахунку, наприклад, за високотемпературними складовими ентальпії H0T – H00 й ентропії S0T – S00 та приведеними потенціалами Гіббса 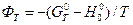 .
.
Результати роботи подати у вигляді таблиці.
| № | t, 0C | P(CO2) | DG0T експ | Розраховані значення | ||
| DG0T | DH0T | DS0T | ||||
Література: [24, с. 246-252, 261-264].
Дата добавления: 2015-09-11; просмотров: 1099;
