Робота № 2/1. Визначення молекулярної маси розчиненої речовини кріоскопічним методом
Мета роботи. Визначити молекулярну масу розчиненої речовини.
Методика роботи.При охолодженні розчинів нелетких речовин нижче температури замерзання розчинників на ΔT відбувається їх кристалізація, а тверда фаза часто складається з чистого розчинника. Умовою рівноваги між розчином і твердою фазою розчинника є рівняння:
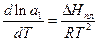 (1)
(1)
де a1 - термодинамічна активність розчинника в розчині, а ΔHпл. - стандартна мольна ентальпія плавлення розчинника.
Врахуємо, що активність чистого розчинника a1 = 1, а температура його замерзання – Т0. Тоді інтегрування рівняння (1) в границях: за активністю - від 1 до a1 , а за температурою -від Т0 до T дає:
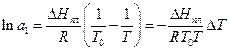 (2)
(2)
Скориставшись рівнянням Гіббса - Дюгема для бінарного розчину
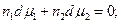
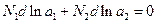 (3)
(3)
можна від рівняння (1) перейти до іншого рівняння, яке відповідає залежності температури замерзання розчину від активності розчиненої речовини:
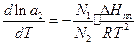 (4)
(4)
У розведених розчинах
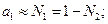
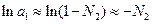 (5)
(5)
Підставляючи це значення в рівняння (2), одержимо
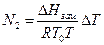 (6)
(6)
Замінюючи концентрацію розчиненої речовини, виражену через мольну частку N2 , на концентрацію, виражену через моляльність m2, а також враховуючи, що для розведених розчинів різниця між T і. T0 є малою і тому 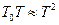 , рівняння (6) можна переписати:
, рівняння (6) можна переписати:
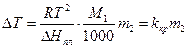 (7)
(7)
де 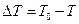 - різниця між температурами замерзання розчинника і розчину; kкр - кріоскопічна стала, а M1 - молекулярна маса розчинника. Кріоскопічна стала
- різниця між температурами замерзання розчинника і розчину; kкр - кріоскопічна стала, а M1 - молекулярна маса розчинника. Кріоскопічна стала
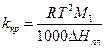 (8)
(8)
визначається властивостями розчинника і не залежить від властивостей розчиненої речовини.
Зниження температури замерзання розчину не залежить від хімічної природи чи розміру часточок розчиненої речовини, а залежить лише від кількості речовини. Якщо приготувати розчин із g1 грамів розчинника і g2 грамів розчиненої речовини з невідомою молекулярною масою M2 , то моляльність такого розчину можна записати у вигляді
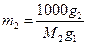 (9)
(9)
Підставляючи це значення в рівняння (7), одержимо
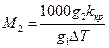 (10)
(10)
Відносна похибка визначення молекулярної маси складається з відносних похибок визначення наважок та зниження температури замерзання:
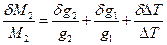 (11)
(11)
Останній доданок робить домінуючий внесок, бо на практиці вимірювання доводиться проводити в інтервалі 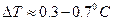 і збільшувати ΔT за рахунок підвищення концентрації розчину не можна через зростання неточності самих рівнянь (7) та (10), виведених з використанням наближень (5). Тому підвищення точності визначення молекулярної маси виявляється можливим, головним чином, за рахунок зменшення похибки вимірювання ΔT, тобто за рахунок зменшення δΔT. Цього можна досягти при використанні термометра Бекмана.
і збільшувати ΔT за рахунок підвищення концентрації розчину не можна через зростання неточності самих рівнянь (7) та (10), виведених з використанням наближень (5). Тому підвищення точності визначення молекулярної маси виявляється можливим, головним чином, за рахунок зменшення похибки вимірювання ΔT, тобто за рахунок зменшення δΔT. Цього можна досягти при використанні термометра Бекмана.
Порядок роботи. Термометр Бекмана - це ртутний термометр, що відрізняється від звичайних значно більшим за об'ємом резервуаром ртуті і значно довшим вузьким капіляром. Завдяки цьому незначні зміни температури спричиняють значні переміщення стовпчика ртуті в капілярі, що й забезпечує необхідну точність вимірювання. Іншою особливістю термометра Бекмана є верхній резервуар ртуті, за рахунок якого можна змінювати кількість ртуті в нижньому (основному) резервуарі. Це дозволяє перевлаштовувати термометр на різні інтервали температур, а відтак, і працювати з різними розчинниками, що замерзають (а також киплять) за різних температур. Із сказаного зрозуміло, що термометром Бекмана не можна виміряти абсолютну температуру, а лише різницю температур. Для цього треба виміряти температуру замерзання чистого розчинника, а потім цим самим термометром (без перевлаштування) - температуру замерзання розчину. Різниця показань цих двох вимірювань дорівнює ΔT.
Вимірювання температур замерзання проводять у кріостаті, схему якого показано на рис. 1. У попередньо висушену і зважену на технічних терезах пробірку 3 наливають таку кількість розчинника, щоб ртутний резервуар термометра Бекмана був повністю занурений в нього, але не торкався дна пробірки, і знову зважують. Пробірку з термометром 1 і мішалкою 2 вміщують в більш широку пробірку 4 і далі в охолоджувальну суміш 5.
Повітряний прошарок між пробірками 3 і 4 забезпечує більш рівномірне охолодження. Охолоджуючу суміш готують з подрібненого льоду та кухонної солі. Температура охолоджуючої суміші повинна бути на 2-3°С нижча за вимірювану температуру замерзання.
Приводять в дію мішалку і спостерігають за зниженням рівня ртуті в капілярі. З початком кристалізації температура деякий час тримається постійною. Іноді має місце переохолодження рідини, після чого відбувається її кристалізація. При цьому за рахунок теплоти кристалізації температура підвищується до справжньої температури замерзання і деякий час залишається постійною. Записують цю температуру. Потім виймають пробірку 3 і нагрівають її рукою, щоб розтопити кристали льоду, після чого повертають на місце для повторного визначення температури замерзання. Цю операцію повторюють до одержання результатів, що відтворюються.
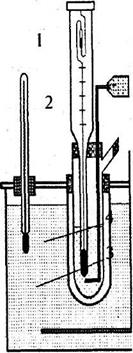
Рис. 1. Схема пристрою для вимірювання температури замерзання рідини:
1 - термометр Бекмана; 2 - мішалка; 3 - скляна пробірка для рідини; 4 - повітряна скляна рубашка; 5 - кріостат з охолоджуючою сумішшю; 6 - термометр
Після закінчення цих вимірювань у пробірку з розчинником вносять розчинювану речовину, відсипаючи із зваженої пробірочки в такій кількості, щоб концентрація утвореного розчину становила 0,1 - 0,2 m2 Зважування пробірочки до і після відсипання речовини здійснюють на аналітичних терезах.
Кристалізація розчину характеризується не точкою на шкалі температур, а інтервалом, бо в процесі кристалізації змінюється концентрація розчину, а отже, й температура замерзання. Тому за температуру замерзання досліджуваного розчину беруть або короткочасну зупинку температури на початку кристалізації (якщо така має місце), або початок сповільнення охолодження. За наявності переохолодження розчину за температуру замерзання приймають максимальне значення, яке спостерігається після початку кристалізації.
Вимірювання температури замерзання розчинів повторюють декілька разів до одержання відтворюваних результатів за такою самою методикою, яка використовується з чистим розчинником (див. вище).
Молекулярну масу розраховують за рівнянням (10), похибку оцінюють, користуючись рівнянням (11).
Література: [22, с. 170-176, 179-184; 21, с. 75-86].
Дата добавления: 2015-09-11; просмотров: 850;
