Робота № 1/1. Визначення теплоємності речовин.
ОСНОВИ ТЕРМОДИНАМІКИ. ОДНОКОМПОНЕНТНІ СИСТЕМИ.
Система та її стани. Параметри та функції стану системи. Перший закон термодинаміки. Внутрішня енергія. Теплота та робота для різних процесів. Теплоємність. Ентальпія.
Інтенсивні та екстенсивні величини. Ентропія. Обчислення ентропії та її фізичний сенс. Абсолютні ентропії, постулат Планка.
Функції стану. Вільна енергія: енергія Гельмгольца та енергія Гіббса. Рівняння Гіббса - Гельмгольца. Співвідношення Максвелла. Методи обчислення та фізичний зміст вільної енергії.
Принцип Нернста. Критерії самочинного перебігу процесів. Другий закон термодинаміки. Напрямок процесів в ізольованій системі.
Термодинаміка фазових переходів. Рівняння Клапейрона -Клаузіуса. Діаграми стану однокомпонентних систем.
Реальні гази. Рівняння стану, рівняння Ван-дер-Ваальса. Леткість реальних газів та методи її обчислення.
Фізична хімія конденсованого стану однокомпонентних систем.
Література: [1-13].
Робота № 1/1. Визначення теплоємності речовин.
Мета роботи. Визначити питому і молярну теплоємність твердого тіла.
Методика роботи. У калориметрі (опис приладу і порядок роботи з ним наведено в роботі № 4/1) вимірюють кількість теплоти, яка необхідна для нагрівання речовини масою m на Δt °С. За цими даними і сталою калориметра обчислюють питому теплоємкість С - кількість теплоти, необхідної для нагрівання одиниці маси речовини на І К.
Порядок роботи. У калориметр приміщують 500 мл дистильованої води. Пропустивши через нагрівач струм, вимірюють зміну температури Δt та величину теплового ефекту (ΔH, Дж) за рівнянням:
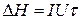 (1)
(1)
де I - сила струму, А; U- напруга, В; τ - час пропускання струму, с.
Відношення
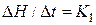 (2)
(2)
називають сталою калориметра. З фізичного погляду K1 - це сума теплоємностей усіх частин калориметра, тобто
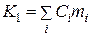 (3)
(3)
де Ci - питома теплоємність речовини; mi - його маса.
Визначення K1 за рівнянням (2) проводять чотири — п'ять разів та знаходять його середнє значення.
Після цього поміщають у калориметр певну наважку (150 -200 г) досліджуваної (не розчинної у воді) речовини (звичайно метал) та, повторюючи описану вище процедуру, знаходять значення K2.
Величина K2 відрізняється від K1 на теплоємність досліджуваної речовини, тобто
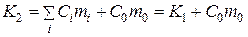 (4)
(4)
де m0 - наважка, г, а C0 - питома теплоємність досліджуваної речовини, Дж/г.
З рівняння (4) знаходять C0, а далі обчислюють мольну теплоємність досліджуваної речовини:
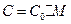 (5)
(5)
де М - молекулярна маса речовини.
Література: [20, с. 24 - 25; 24, с. 144].
Дата добавления: 2015-09-11; просмотров: 551;
