Контрольные задания. 16. Каковы значения квантовых чисел (n, l, m) для орбиталей, входящих в 3d – подуровень?
16. Каковы значения квантовых чисел (n, l, m) для орбиталей, входящих в 3d – подуровень?
17. Сколько вакантных 3d – орбиталей имеют атомы в возбуждённом состоянии: а) Cl, б)V, в)Mn?
18. Сколько значений магнитного квантового числа возможно для электронов энергетического подуровня, орбитальное квантовое число которого l = 2? l = 3?
19. Составить электронные формулы атомов и ионов
а) Cd, б) I-, в) Fe3+, г) S, д) Na+.
Литература
1. Общая химия. Учебник для медицинских вузов / В. А. Попков, С. А. Пузаков.–
Москва : Высшая школа, 2010 г.– С. 15 – 29.
2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студентов медицинских спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; Под ред. Ю.А. Ершова, В.А. Попкова. – Москва. : Высш. шк., 2008. – С.115-12
ХИМИЧЕСКАЯ СВЯЗЬ
Химическая связь – это взаимодействие, которое связывает отдельные атомы в молекулы, ионы, радикалы, кристаллы.
Основным условием образования химической связи является понижение полной энергии многоатомной системы по сравнению с энергией изолированных атомов, т.е. ЕАВ<ЕА+ЕВ в случае образования вещества АВ из А и В. Более точно химическую связь можно определить как взаимодействие атомов, обусловленное перекрыванием их электронных облаков, и сопровождающееся уменьшением полной энергии системы.
Основными параметрами химической связи является её длина, прочность и валентные углы, характеризующие строение веществ, которые образованы из отдельных атомов.
Длина связи – это межъядерное расстояние между химически связанными атомами.
Угол между воображаемыми прямыми, проходящими через ядра химически связанных атомов, называется валентным углом.
Энергия связи – энергия, необходимая для разрыва связи.
Ионная связь
Для объяснения ионной связи необходимо уяснить себе следующие понятия:
Потенциал ионизации – энергия, которую необходимо затратить для удаления 1-го электрона с внешней орбитали, при этом атом переходит из нейтрального в положительно заряженный ион (катион).
Чем меньше потенциал ионизации, тем легче атом теряет электроны, тем сильнее выражены у электрона металлические свойства. Потенциал ионизации растет в пределах периода слева направо, уменьшается сверху вниз.
Атом может не только терять электроны, но и присоединять. Энергия, которая выделяется при присоединении электронов к атому, называется сродством к электрону. Чем больше эта энергия, тем более неметалл этот элемент. Сродство к электрону увеличивается слева направо, уменьшается сверху вниз. Условная величина, характеризующая способность атома притягивать к себе электроны называется электроотрицательностью. Она равна полусумме потенциала ионизации и энергии сродства к электрону: 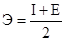 (
(  ядра). Электроотрицательность растет слева направо и уменьшается сверху вниз (увеличение числа электронных оболочек). Наиболее электроотрицательный элемент –
ядра). Электроотрицательность растет слева направо и уменьшается сверху вниз (увеличение числа электронных оболочек). Наиболее электроотрицательный элемент –  .
.
В зависимости от величины электроотрицательности все элементы делятся на:
1. электроположительные (элементы 1-3 группы)
2. электроотрицательные (все остальные элементы)
Ионная связь образуется между элементами сильно отличающимися по электроотрицательности, а именно DЭ>1,9.
Полинг ввел шкалу электроотрицательности.
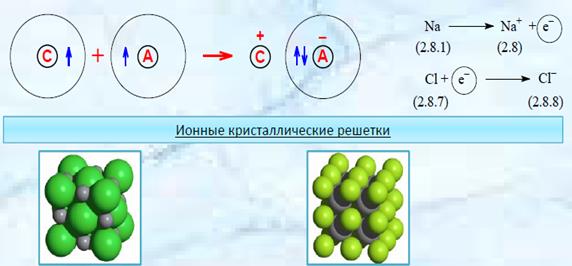
Ионная связь образуется за счет перехода одного или нескольких электронов от одного атома на внешнюю оболочку другого атома.
Атом, отдавший электрон становится положительно заряженным, а получивший – отрицательно заряженный. 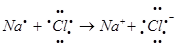
Связь между разноименными ионами осуществляется за счет сил электростатического притяжения.
Образование ионной связи происходит по октаэдрическому правилу. Согласно этому правилу атом принимает, теряет или разделяет электроны таким образом, чтобы электронное облако для него соответствовало ближайшему инертному газу.
1S22S22P63S1 (  ) 1S22S22P63S23P5 (
) 1S22S22P63S23P5 ( 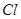 )
)
1S22S22P6 ( 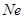 ) 1S22S22P63S23P6 (
) 1S22S22P63S23P6 (  )
)
Ионная связь наиболее характерна для неорганических соединений.
Ковалентная связь
Тип химической связи между атомами, возникающей при обобществлении электронов, которые принадлежат этим атомам.
Для объяснения ковалентной связи используют 2 метода квантово-механического расчета:
1. метод валентных связей (МВС)
2. метод молекулярных орбиталей (ММО)
Согласно методу валентных связей ковалентная связь образуется не путем передачи, а путем обобществления неспаренных электронов с антипараллельными спинами по 1-му от каждого атома. Образовавшаяся в этом случае электронная пара принадлежит обоим атомам. 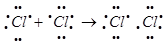
 −
−  – обозначение ковалентной связи.
– обозначение ковалентной связи.
Чем в большей степени перекрываются атомные орбитали, тем прочнее связь.
Перекрывание атомных орбиталей возможно лишь при их определенной взаимной ориентации в пространстве.
Ковалентная связь в отличие от ионной имеет направленность.
Атомные орбитали могут перекрываться двумя способами:
1-ый способ: перекрывание в направлении главных осей (осей, связывающих ядра).
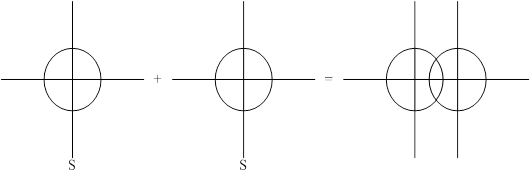
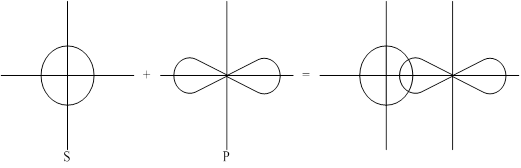
Образовавшаяся при этом перекрывании ковалентная связь называется s-сигма связь.
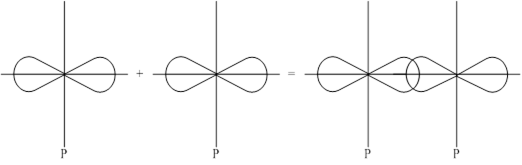
2-ой способ: P-орбитали с параллельными осями.
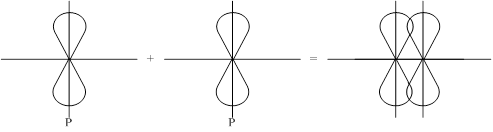
Боковое перекрывание образует p-связь, менее прочную связь чем s- сигма.
В соответствии с правилом Паули между двумя атомами может быть либо 1s-сигма связь, либо 1s-сигма и 1p-связь, либо 1s-сигма и 2p-связи.
Связи:
одинарная 1s −
двойная 1s+1p =
тройная 1s+2p ≡
При увеличении кратности, длина уменьшается:
одинарная – 1,54 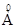
двойная – 1,34 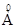
тройная – 1,2 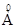
Так как нахождение 2-х электронов в поле действия 2-х ядер энергетически выгоднее, чем пребывание каждого электрона в поле своего ядра, то в образовании ковалентной связи принимает участие все одноэлектронные орбитали внешнего энергетического уровня. Например, атом азота имеет три неспаренных электрона на внешнем уровне и может образовывать за счет таких электронов 3 ковалентных связи. Число неспаренных электронов может увеличиваться при переходе атома в возбужденное состояние за счет “расспаривания”: у 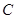 в этом случае атом способен образовывать 4 связи. “Расспаривание” электрона требует затраты энергии, которая компенсируется при образовании связей.
в этом случае атом способен образовывать 4 связи. “Расспаривание” электрона требует затраты энергии, которая компенсируется при образовании связей.
При участии в образовании s-связей орбиталей разных типов, например, в молекуле  следовало бы ожидать формирование связей, отличающихся друг от друга по длине и прочности. Однако все связи
следовало бы ожидать формирование связей, отличающихся друг от друга по длине и прочности. Однако все связи  −
−  равноценны и располагаются симметрично друг другу. В рамках МВС эти факты объясняются на основе концепции гибридизации атомных валентных орбиталей. Согласно ей в валентных состояниях электроны распределяются не на чистых S и P орбиталях, а на смешанных (гибридных). Число гибридных равно числу атомных орбиталей. Гибридные орбитали одинаковы по форме и энергии. В отличии от атомных орбиталей гибридные более вытянуты в направлении образования химической связи.
равноценны и располагаются симметрично друг другу. В рамках МВС эти факты объясняются на основе концепции гибридизации атомных валентных орбиталей. Согласно ей в валентных состояниях электроны распределяются не на чистых S и P орбиталях, а на смешанных (гибридных). Число гибридных равно числу атомных орбиталей. Гибридные орбитали одинаковы по форме и энергии. В отличии от атомных орбиталей гибридные более вытянуты в направлении образования химической связи.
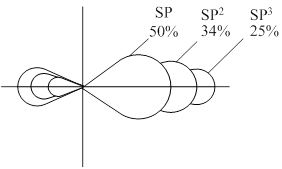
Типы гибридизаций:
SP3 – гибридизация – при взаимодействии 1S и 3P орбиталей,
SP2 – гибридизация – при взаимодействии 1S и 2P орбиталей,
SP – гибридизация – при взаимодействии 1S и 1P орбиталей
Доля s-орбитали составляет:
SP- гибридизации – 50%,
SP2- гибридизации – 34%,
SP3- гибридизации – 25%.
МВС не всегда объясняет ряд свойств веществ: спектральные, магнитные.
Метод молекулярных орбиталей предполагает, что при образовании ковалентной связи атомные орбитали образуют молекулярные орбитали. С позиции ММО каждый электрон принадлежит всей молекуле и движется в поле всех её ядер и электронов, т. е. находится на орбитали, охватывающей всю молекулу. Такая орбиталь называется молекулярной. Молекулярная орбиталь (МО) представляет собой линейную комбинацию атомных орбиталей: yAB=yA+yB. При сложении волновых функций атомных орбиталей образуется связывающая молекулярная орбиталь. При вычитании образуется разрыхляющая молекулярная орбиталь. При переходе атомных орбиталей в связующую молекулярную орбиталь происходит уменьшение энергии, а при разрыхляющих – энергия увеличивается. Связывающая молекулярная орбиталь характеризуется повышением электронной плотности между двумя ядрами.
Образование связывающей и разрыхляющей МО из исходной АО:
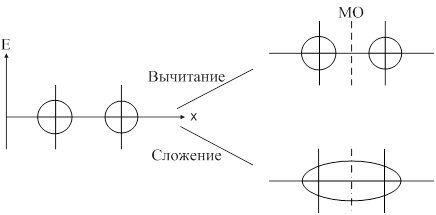

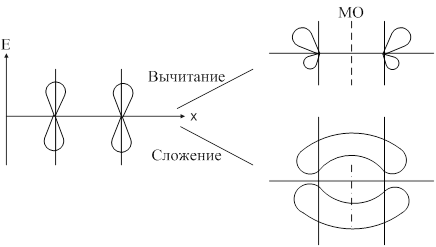
Согласно ММО образование химического соединения возможно только тогда, когда число электронов на связывающей МО больше числа электронов на разрыхляющих.
Полуразность числа электронов на связывающих и разрыхляющих орбиталях называется порядком связи.
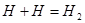
 - порядок связи (валентность)
- порядок связи (валентность)

Ковалентная связь характеризуется длиной, энергией, полярностью, поляризуемостью и имеет определённую направленность в пространстве.
С увеличением кратности связи, длина связи уменьшается:
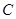 −
−  0,154 нм
0,154 нм
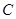 =
= 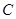 0,134 нм
0,134 нм
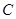 ≡
≡ 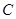 0,12 нм
0,12 нм
Энергия связи – энергия, которую надо затратить, чтобы разорвать химическую связь. Тоже количество энергии выделяется при образовании химической связи. С увеличением кратности связи, энергия увеличивается. Энергия p-связи меньше энергии s-связи.
Ковалентная связь может быть:
1. полярной (если атомы различаются по электроотрицательности, то электронная пара будет смещаться к атому с большей электроотрицательностью) 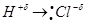
2. неполярной (между атомами 1-го типа, с одинаковой электроотрицательностью)  −
− 
Мерой полярности служит дипольный момент: 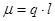 , где
, где
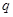 −заряд электрона,
−заряд электрона,
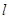 −расстояние между центрами заряда.
−расстояние между центрами заряда.
С увеличением электроотрицательности одного из атомов полярность молекулы увеличивается.
Процесс смещения электронной пары к наиболее электроотрицательному атому называется поляризацией.
Поляризуемость – динамическая поляризация, способность молекулы изменять свою полярность под действием внешнего электрического поля. Поляризуемость уменьшается с уменьшением размера атома:
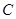 −
−  >
> 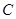 −
− 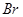 >
> 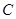 −
− 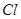 >
> 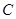 −
− 
3. Координационная связь – (донорно-акцепторная) может рассматриваться, как результат наложения ионных и ковалентных связей
Координационная связь, как и ковалентная связь обладает определенной жесткостью, однако атомы, образующие эту связь несут на себе  как в ионной связи. При образовании координационной связи атомы приобретают заряды. Образование координационной связи происходит в результате обобщения пары электронов, принадлежащих только одному атому – донору, в то время как второй является акцептором, имеющим свободную орбиталь.
как в ионной связи. При образовании координационной связи атомы приобретают заряды. Образование координационной связи происходит в результате обобщения пары электронов, принадлежащих только одному атому – донору, в то время как второй является акцептором, имеющим свободную орбиталь.
Классический пример образования иона аммония:
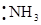
2P




 2S ↑ ↑ ↑
2S ↑ ↑ ↑

 ↓↑
↓↑

2S22Px12Py12Pz1

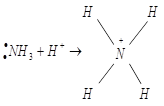
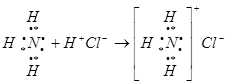
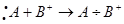
Разновидностью донорно-акцепторной связи является семиполярная связь. Она образуется, как и донорно-акцепторная, но донор заряжён положительно «+», а акцептор отрицательно «−».

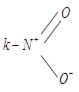
Дата добавления: 2015-11-20; просмотров: 1713;
