Металлическая связь. При обычных условиях металлы, за исключением ртути Hg, существуют в виде кристаллов
При обычных условиях металлы, за исключением ртути Hg, существуют в виде кристаллов. Взаимодействие, удерживающее атомы металлов в едином кристалле, называется металлической связью.
Природа металлической связи подобна ковалентной связи: оба типа связи основаны на обобществлении валентных электронов. Однако в атомах металлов количество таких электронов меньше количества вакантных орбиталей. Электроны слабо удерживаются ядром. Поэтому они могут переходить из одной орбитали в другую. Стремясь принять более устойчивое состояние, а это структура инертного газа, атомы металлов довольно легко отдают валентные электронные электроны, превращаясь в положительно заряжённые ионы. Внутри этой решётки находятся валентные электроны, которые не принадлежат конкретно какому-то атому. Благодаря малым размерам электроны более или менее свободно перемещаются по всему объёму кристаллической решётки, поэтому возникает большое число многоцентрированных орбиталей. Электроны на этих орбиталях обобщены сразу несколькими атомами.
Благодаря свободному перемещению электронов металлы обладают высокой электрической проводимостью и теплопроводностью.
По прочности металлическая связь меньше ковалентной связи в 3-4 раза. Металлическая связь не имеет определённой направленности в пространстве. Электроны сталкиваясь с ионами образуют нейтральные частицы, которые сразу теряют электроны: 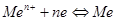 . Электронные газы отражают световые лучи.
. Электронные газы отражают световые лучи.
В результате движения внутри решётки электроны способны переносить тепловую энергию от нагретых участков к ненагретым, этим объясняется теплопроводность.
Если приложить нагрузку к металлу, происходит деформация без разрушения решётки, металлам характерна ковкость, пластичность.
5. Водородная связь – одна из разновидностей межмолекулярного взаимодействия
Когда очень электроотрицательный атом ( 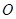 ,
, 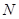 ,
, 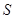 ) связан с атомом
) связан с атомом  , последний в результате смещения электронной пары ковалентной связи к наиболее электроотрицательному атому становится настолько электроно-дефицитным, что начинает проявлять остаточное сродство к электрону и поэтому он способен образовывать донорную связь:
, последний в результате смещения электронной пары ковалентной связи к наиболее электроотрицательному атому становится настолько электроно-дефицитным, что начинает проявлять остаточное сродство к электрону и поэтому он способен образовывать донорную связь:
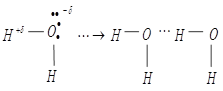
Различают водородную связь: межмолекулярную и внутримолекулярную.
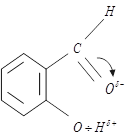
Энергия водородной связи на 1, 2 порядка меньше энергии ковалентной связи.
Дата добавления: 2015-11-20; просмотров: 1084;
