Электронные семейства элементов
Принадлежность элемента к электронному семейству определяется характером заполнения энергетических подуровней:
s- элементы – заполнение внешнего s - подуровня при наличии на предвнешнем уровне двух или восьми электронов, например:
Li 1s2 2s2
s-элементы являются активными металлами, характерные степени окисления которых численно равны количеству электронов на последнем уровне:
+1 для щелочных металлов и +2 для элементов второй группы
р- элементы – заполнение внешнего p- подуровня, например:
F 1s2 2s2 2p5
Элементы от В до Ne включительно образуют первую серию p-элементов (элементы главных подгрупп), в атомах которых наиболее удаленные от ядра электроны располагаются на втором подуровне внешнего энергетического уровня.
d- элементы – заполнение предвнешнего d- подуровня, например:
V 1s22s22p63s23p64s23d3
d- элементы относятся к металлам.
f- элементы – заполнение f- подуровня второго снаружи уровня, например:
 Nd 1s2 2s2 2p2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f4
Nd 1s2 2s2 2p2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f4
f- элементы – это элементы семейств актиноидов и лантаноидов.
Квантовая механика, сравнивая электронные конфигурации атомов приходит к следующим теоретическим выводам:
1. Строение внешней оболочки атома является периодической функцией зарядового числа атома Z.
2. Поскольку химические свойства атома определяются строением внешней оболочки, из предыдущего пункта следует: химические свойства элементов находятся в периодической зависимости от заряда ядра.
Контрольные вопросы
1. Ядерная модель строения атома. Изотопы (радионуклиды).
2. Квантово - механическая модель строения атома.
3. Квантовые числа (главное, орбитальное, магнитное, спиновое).
4. Строение электронных оболочек атомов. Принцип Паули. Принцип наименьшей энергии. Правило Гунда.
5. Электронно-структурные формулы атомов. Гибридизация атомных орбиталей.
6. Характеристики атома. Атомный радиус. Электроотрицательность. Сродство к электрону. Энергия ионизации. S, p, d, f – электронные семейтсва атомов.
Типовые задачи
Задача № 1.Радиусы ионов Na+ и Cu+ одинаковы (0,098 нм). Объяснить различие температур плавления хлорида натрия (801°С) и хлорида меди(I) (430°С).
Решение:
При одинаковых зарядах и размерах ионов Na+ и Cu+ ,ион Cu+ имеет 18 – электронную внешнюю оболочку и более сильно поляризует анион Cl- , чем ион Na+, обладающий электронной структурой благородного газа. Поэтому в хлориде меди(I) в результате поляризации с аниона на катион переносится более значительная часть электронного заряда, чем в хлориде натрия. Эффективные заряды ионов в кристалле CuCl становятся меньше, чем NaCl, а электростатическое взаимодействие между ними – более слабое. Этим объясняется более низкая температура плавления CuCl в сравнении с NaCl, кристаллическая решётка которого близка к чисто ионному типу.
Задача №2. Как обозначается состояние электрона а) с n=4,L=2; б) с n=5,L=3.
Решение: При записи энергетического состояния цифрой указывают номер уровня (n), а буквой - характер подуровня (s, p, d, f). При n=4 и L=2 записываем 4d; при n=5 и L=3 записываем 5f.
Задача № 3. Сколько всего орбиталей соответствует третьему энергетическому уровню? Сколько электронов на этом уровне? На сколько подуровней расщепляется этот уровень?
Решение: Для третьего энергетического уровня n=3, количество атомных орбиталей 9(32), что
является суммой 1(s) +3(p) +5(d)=9. По принципу Паули количество электронов на этом уровне 18. Третий энергетический уровень расщепляется на три подуровня: s,p,d (количество подуровней совпадает с числом значений главного квантового числа).
Задача №4. На какие электронные семейства классифицируются химические элементы?
Решение: Все химические элементы можно классифицировать в зависимости от характера заполняемых подуровней на 4 типа:
s-элементы-заполняют электронами ns подуровень;
p-элементы -заполняют электронами np подуровень;
d-элементы-заполняют электронами (n-1)d подуровень;
f-элементы –заполняют электронами (n-2)f подуровень;
Задача № 5. Какой подуровень заполняется в атоме электронами после заполнения подуровня: а) 4р; б)4s
Решение: А) подуровню 4р отвечает сумма (n+1), равная 4+1=5. Такой же суммой характеризуются подуровни 3d (3+2=5) и 5s (5+0=5). Однако состоянию 3d отвечает меньшее значение n (n=3), чем состоянию 4р, поэтому подуровень 3d будет заполняться раньше, чем подуровень 4р. Следовательно, после заполнения подуровня 4р будет заполняться подуровень 5s, которому отвечает на единицу большее значение n(n=5).
Б) подуровню 4s соответствует сумма n+1=4+0=4. Такой же суммой n+1 характеризуется подуровень 3р, но заполнение этого подуровня предшествует заполнению подуровня 4s, т.к. последнему отвечает большее значение главного квантового числа. Следовательно, после подуровня 4s будет заполняться подуровень с суммой (n+1)=5,причем из всех возможных комбинаций n+l, соответствующих этой сумме(n=3, l=2; n=4; l=1; n=5; l=0), первой будет реализоваться комбинация с наименьшим значением главного квантового числа, то есть вслед за подуровнем 4s будет заполняться подуровень 3d.
Вывод: таким образом, заполнение подуровня d отстает на один квантовый уровень, заполнение подуровня f отстает на два квантовых уровня.
Для написания электронной формулы элемента необходимо: арабской цифрой указать номер энергетического уровня, написать буквенное значение подуровня, количество электронов записать в виде показателя степени.
Например: 26Fe4 1s22s22p63s23p64s23d6
Электронная формула составлена с учетом конкуренции подуровней, т.е. правила минимума энергии. Без учета последнего электронная формула будет записываться : 26Fe41s22s22p63s23p63d64s2.
Задача № 6. Электронная структура атома описывается формулой 1s22s22p63s23d74s2. Какой это элемент?
Решение: Этот элемент принадлежит к электронному типу d-элементов 4 периода , т.к. происходит застройка электронами 3d подуровня; число электронов 3d 7 свидетельствует о том, что это седьмой элемент по порядку. Общее число электронов 27,значит порядковый номер 27. Этот элемент кобальт.
Тестовые задания
Выберите правильный вариант ответа
01.ЭЛЕКТРОННАЯ ФОРМУЛА ЭЛЕМЕНТА ИМЕЕТ ВИД … 5S24D4. УКАЗАТЬ ЧИСЛО ЭЛЕКТРОНОВ В НАРУЖНОМ УРОВНЕ
1) 1
2) 3
3) 4
4) 6
02. МОГУТ ЛИ СУЩЕСТВОВАТЬ В АТОМЕ ДВА ЭЛЕКТРОНА С ОДИНАКОВЫМ НАБОРОМ ВСЕХ ЧЕТЫРЕХ КВАНТОВЫХ ЧИСЕЛ?
1) не могут
Могут
3) могут только в возбужденном состоянии
4) могут только в нормальном (невозбужденном) состоянии
03. КАКОЙ ПОДУРОВЕНЬ ЗАПОЛНЯЕТСЯ ПОСЛЕ ПОДУРОВНЯ 4D?
1) 4f
2) 5s
3) 5p
4) 6p
04. ЭЛЕКТРОННАЯ ФОРМУЛА ЭЛЕМЕНТА 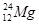 ИМЕЕТ ВИД: 1S22S22P63S2. УКАЗАТЬ ЧИСЛО ВАЛЕНТНЫХ ЭЛЕКТРОНОВ
ИМЕЕТ ВИД: 1S22S22P63S2. УКАЗАТЬ ЧИСЛО ВАЛЕНТНЫХ ЭЛЕКТРОНОВ
1) 8
2) 3
3) 5
4) 2
05. ЭЛЕКТРОННАЯ ФОРМУЛА ЭЛЕМЕНТА ИМЕЕТ ВИД: 1S22S22P63S23P64S23D7. КАКОЙ ЭТО ЭЛЕМЕНТ?
1) 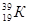
2) 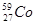
3) 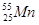
4) 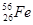
06. КАКОЙ ПОДУРОВЕНЬ ЗАПОЛНЯЕТСЯ ПЕРЕД 4D-ПОДУРОВНЕМ?
1) 4f
2) 5s
3) 6s
4) 6p
07. СРЕДИ ПРИВЕДЕННЫХ НИЖЕ ЭЛЕКТРОННЫХ КОНФИГУРАЦИЙ УКАЗАТЬ НЕВОЗМОЖНУЮ
1) 2р3
2) 3р6
3) 2s2
4) 2d2
08. ЭЛЕКТРОННАЯ СТРУКТУРА АТОМА ЭЛЕМЕНТА ВЫРАЖАЕТСЯ ФОРМУЛОЙ: 5S24D3. ОПРЕДЕЛИТЬ КАКОЙ ЭТО ЭЛЕМЕНТ.
1) 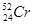
2) 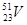
3) 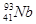
4) 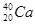
09. У КАКОГО ЭЛЕМЕНТА НАЧИНАЕТСЯ ЗАПОЛНЕНИЕ ПОДУРОВНЯ 4D?
1) 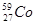
2)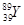
3) 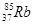
4) 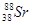
10. У КАКОГО ЭЛЕМЕНТА ЗАКАНЧИВАЕТСЯ ЗАПОЛНЕНИЕ ПОДУРОВНЯ 3D?
1) 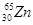
2) 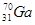
3) 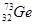
4) 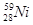
11. ОПРЕДЕЛИТЕ ЭЛЕКТРОННУЮ ЕМКОСТЬ (ВМЕСТИМОСТЬ) ТРЕТЬЕГО ЭНЕРГЕТИЧЕСКОГО УРОВНЯ
1) 3
2) 18
3) 2
4) 32
12. СКОЛЬКО ЗНАЧЕНИЙ ПРИНИМАЕТ ML ПРИ L =3?
1) 3
2) 6
3) 7
4) 9
13. СКОЛЬКО НЕСПАРЕННЫХ ЭЛЕКТРОНОВ В НЕВОЗБУЖДЕННОМ СОСТОЯНИИ ИМЕЕТ АТОМ ФОСФОРА?
1) 1
2) 2
3) 4
4) 5
14. КАКИЕ ЗНАЧЕНИЯ ПРИНИМАЕТ ПОБОЧНОЕ КВАНТОВОЕ ЧИСЛО (L), ЕСЛИ ЗНАЧЕНИЕ ГЛАВНОГО КВАНТОВОГО ЧИСЛА (N) РАВНО 3?
1) 0,1, 2
2) 1, 2, 3
3) 3, 4, 5
4) 1,3, 5
15. ПРИЗНАКОМ СХОДСТВА ХИМИЧЕСКИХ БИОГЕННЫХ ЭЛЕМЕНТОВ НАТРИЯ И КАЛИЯ ЯВЛЯЕТСЯ ОДИНАКОВОЕ ЧИСЛО
1) электронов внешнего слоя
2) номера группы
3) электронных слоев
4) нейтронов в ядре
Дата добавления: 2015-11-20; просмотров: 6936;
