Межмолекулярное взаимодействие
Взаимодействие между молекулами без образования химической связи – это электростатическое взаимодействие (силы Ван-дер-Ваальса). Они обуславливают притяжение молекул и агрегацию вещества, превращение газов в жидкое состояние и далее в твёрдое.
Различают 3 типа электростатического воздействия:
1. ориентационное (диполь-дипольное) – осуществляется в результате взаимодействия ориентированных полюсов полярных молекул при сближении;
2. индукционное – электростатическое взаимодействие полярных и неполярных молекул (Допустим, встречаются полярная и неполярная молекулы. Под действием полярной молекулы неполярная деформируется и в ней возникает (индуцируется) диполь. Индуцированный диполь притягивается к постоянному диполю полярной молекулы и в свою очередь усиливает электрический момент диполя полярной группы);
3. дисперсионное – возникает в результате взаимного притяжения так называемых мгновенных диполей в неполярных молекулах вследствие несовпадения центров тяжести электронного облака и ядер: 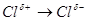 .
.
Ван-дер-Ваальсово взаимодействие очень слабо по сравнению с ковалентной связью (если энергия диссоциации 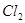 на атомы = 243 кДж/моль, то энергия сублимации (возгонки) кристаллов
на атомы = 243 кДж/моль, то энергия сублимации (возгонки) кристаллов 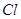 = 25 кДж/моль).
= 25 кДж/моль).
Контрольные вопросы
1. Химическая связь. Валентность.
2. Основные характеристики химической связи: длина связи, энергия связи, валентный угол, полярность и поляризуемость химической связи.
3. Ионная связь, её свойства. Свойства ионных соединений. Метод валентных связей (ВС). Переменная валентность.
4. Метод валентных связей (ВС). Переменная валентность.
5. Ковалентная связь и механизмы её образования. Свойства ковалентной связи (направленность, насыщаемость). Гибридизация атомных орбиталей.
6. Металлическая связь.
7. Водородная связь, её биологическая роль.
Типовые задачи
Задача №1
Вычеслите разность относительных электроотрицательностей атомов для связей Н-О и Э-О в соединениях Э (ОН)₂ , где Э- элементы Са, Sr, Ba, и определите:
А) какая связь Н-О или Э-О характеризуется в каждой малекуле большей степенью ионности;
Б) каков характер ионизации этих молекул в водном растворе?
Решение:
А) Вычислим ΔΧ для связи Э-О и Н-О:
ΔΧ Са-О=3,5-1,04=2,46
ΔΧ Sr-O=3,5-0,99=2,51
ΔΧ Ba-O=3,5-0,90=2,60
ΔΧ H-O=3,5-2,1=1,4
Из сравнения ΔΧ видим, что связь Э-О можно считать ионной, связь Н-О – полярной.
Б) Ионизация в водных растворах будет осуществляться по наиболее ионной связи, то есть по схеме Э (ОН)₂ ↔ Э²⁺ + 2ОН⁻(по типу оснований).
Задача № 2
Покажите образование связи в молекуле BF3 и в ионе BF-4.Объясните строение указанных частиц.
Решение:1) Составим электронные формулы атомов и ионов: В 1s22s22p1; F1s22s22p5;F- 1s22s22p6.
2) Покажем распределение электронов по валентным орбиталям. При этом учтем степень окисления атома бора в соединении (условно можно считать, что число неспаренных электронов в атоме соответствует степени окисления).
Вǂ ↑ 2s ↑ ↑ 2p F ↑↓ 2s ↓↑ ↑↓ ↓ 2p
F- ↑↓ 2s ↓↑ ↑↓ ↓↑ 2p
3) Покажем образование всех возможных связей, укажем механизм их образования:
3F ↑↓ ↑↓ ↑↓ ↑
Bǂ ↓ ↓ ↓
Образовалось 3 сигма связи по обменному механизму. Исходя из валентных возможностей атома бора и его стремления к насыщаемости, покажем образование π связи по донорно-акцепторному механизму. Но, т.к. эта связь объединяет более двух атомов, она будет нелокализованной. В ионе BF-4 образуется 4 сигма связи, из них по три по обменному и одна-по донорно-акцепторному механизму.
3F ↑↓ ↑↓ ↑↓ ↓ Bǂ ↑ ↑ ↑ F- ↑↓ ↓↑ ↑↓ ↓↑
4) Рассчитаем кратность связи как отношение общего числа к числу сигма связей. В молекуле BF3 кратность связи 1⅓ ,в ионе BF-4 кратность связи 1.
5) Определим состояние центрального атома с точки зрения насыщаемости. В молекуле BF3 проявлена максимальная валентность за счет сигма и π связей, следовательно, состояние атома бора валентно-насыщенное. В ионе BF-4 проявлена максимальная валентность за счет сигма связей, следовательно, состояние атома бора координационно-насыщенное.
6) Определим характер связи В-F с точки зрения полярности. Т.к. различие в величине электроотрицательности составляет 4,0-2,0=2,0., то есть больше 1,9, связь можно считать ионной
7) Определим тип гибридизации атомных орбиталей центрального атома и геометрическую форму частиц.
В молекуле BF3 в образовании сигма связей участвуют 2s и 2p орбитали,следовательно,тип гибридизации sp2. Молекула имеет треугольную структуру. В ионе BF-4 в образовании сигма связей участвуют одна s и три p-орбитали, следовательно, тип гибридизации sp3. И он имеет тетраэдрическую форму. Изобразим графически:
F ↖ ↗ F F
↑
B F ←B→ F
↓F ↓
F
Задача № 3
Покажите образование связей в молекуле SO3 ,объясните строение молекулы.
Решение: Электронные формулы элементов:
S 1s22s2p63s23p4 O 1s22s22p4
Атом серы образует по обменному механизму 3 сигма связи( за счет 1 s и двух p-атомных орбиталей) и 3π связи (за счет одной р и двух d атомных орбиталей). Следовательно, атом валентно-насыщен, координационно-ненасыщен, кратность связи 6/3=2. Связь S-O полярная, общие электронные пары смещены к кислороду. Тип гибридизации sp2. Молекула имеет форму треугольника.
Тестовые задания
01. В МОЛЕКУЛЕ АММИАКА ВСЕ СВЯЗИ
1) донорно-акцепторные
2) ионные
3) ковалентные неполярные
4) ковалентные полярные
02. ВЕЩЕСТВО, В МОЛЕКУЛЕ КОТОРОГО СОДЕРЖИТСЯ КРАТНАЯ СВЯЗЬ, НАЗЫВАЕТСЯ
1) кислород
2) водород
3) сероводород
4) хлороводород
03. ВЕЩЕСТВА, СОДЕРЖАЩИЕ ТОЛЬКО КОВАЛЕНТНЫЕ ПОЛЯРНЫЕ ХИМИЧЕСКИЕ СВЯЗИ, ПРИВЕДЕНЫ В РЯДУ
1) F2 Н2SО4 Р2О5
2) РF5 Сl2О7 NН4Сl
3) NО2 SОСl2 СН3СООН
4) Н3РО4 ВF3 СН3СООNН4
04. ВЕЩЕСТВО, В МОЛЕКУЛЕ КОТОРОГО СОДЕРЖИТСЯ 2σ И 2π СВЯЗИ, ИМЕЕТ ФОРМУЛУ
1) NO2
2) H2CO3
3) CO2
4) CH3OH
05. ВЕЩЕСТВАМИ, В КОТОРЫХ ВСЕ СВЯЗИ КОВАЛЕНТНЫЕ, ЯВЛЯЮТСЯ
1) СО2, Н2S
2) NH4Cl, P2O5
3) К2SO4, NH3
4) NaCl, SO2
06. ИОННАЯ СВЯЗЬ ОБРАЗУЕТСЯ МЕЖДУ ЭЛЕМЕНТАМИ
1) Na и F
2) P и O
3) C и H
4) S и Cl
07. ИОННАЯ СВЯЗЬ ОБРАЗУЕТСЯ МЕЖДУ ЭЛЕМЕНТАМИ
1) К и Cl
2) C и О
3) C и H
4) P и O
08. НЕПОЛЯРНОЙ ЯВЛЯЕТСЯ МОЛЕКУЛА
1) линейная НСN;
2) тетраэдрическая СF4
3) угловая SО2
4) пирамидальная РН3
09. ОБЩЕЕ ЧИСЛО ЭЛЕКТРОНОВ, УЧАСТВУЮЩИХ В ОБРАЗОВАНИИ СВЯЗЕЙ В МОЛЕКУЛЕ УГЛЕКИСЛОГО ГАЗА, РАВНО
1) 8
2) 4
3) 5
4) 7
10. ПОЛЯРНОЙ ГРУППОЙ, КОТОРАЯ МОЖЕТ ВХОДИТЬ В СОСТАВ ПАВ, ЯВЛЯЕТСЯ
1) Сl
2) NO3
3) COOH
4) NO2
11. СТЕПЕНЬ ИОННОСТИ СВЯЗЕЙ ВОЗРАСТАЕТ В РЯДУ
1) Na2O, BaO, CO2
2) ССl4, NaCl, MgCl2
3) Н2О, СН4, СаН2
4) ВН3, ВеН2, LiH
12. ФОРМУЛА ВЕЩЕСТВА С МОЛЕКУЛЯРНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ ИМЕЕТ ВИД
1) СаО
2) NH3
3) KCl
4) CaH2
Дата добавления: 2015-11-20; просмотров: 2106;
