Донорно-акцепторная (координационная) связь. Комплексные соединения
В ковалентной связи между 2-мя атомами общая пара электронов создается обоими атомами. В других случаях октет электронной оболочки, может быть, достигнут путем предоставления обоих электронов одним из атомов. Получившаяся ковалентная связь называется координационной или донорно-акцепторной связью.
Частицы, которые предоставляют электроны называются донорами, a которые их включают как общую пару на свой энергетический уровень - называются aкцепторами. Донором может быть частица, содержащая электронную пару на своем внешнем уровне и эта пара не участвует в образовании связи с другими частицами (неподеленная электронная пара). Донорами являются обычно молекулы содержащие атомы N, O, F, P, S или Cl, соединенные с атомами других элементов. Акцептором может быть частица, имеющая вакантный (незаполненный) электронный уровень. Акцепторы - это часто атомы переходных металлов, имеющих незаполненные d-подуровни.
В каждом случае свободная пара электронов (т.е пара электронов, которая не принимает участие в образовании связей), принадлежащая молекуле или иону, используется на образование каждой координационной связи. Такие молекулы (ионы) называются лигандами и соединения, которые образованы таким образом, называются координационными соединениями или комплексными соединениями.
Например, рассмотрим пример гидратации гидратации Al иона (гидратирования ион) при растворении AlCl3 в воде. Электронная структура алюминия 1s22s22p63s23px1. Когда образуется ион Al3+, атом алюминия теряет электроны 3-го уровня, в результате получается электронная конфигурация 1s22s22p6, что означает, что 3-уровневые орбитали свободны. Далее происходит реорганизация (гибридизация) этих шести пустых орбиталей (одна 3s, три 3p и две 3d) и получается шесть новых орбиталей с одинаковой энергией. Эти шесть гибридных орбиталей принимают свободные электронные пары от 6 молекул воды.
Почему тут использованы 6 орбиталей, а не 4 или 8 или какое-либо другое число орбиталей? Шесть - это максимальное число молекул воды, которое может быть размещено вокруг иона алюминия (и большинства ионов других металлов). При создании максимального количество связей высвобождается максимальное количество энергии, и структура становится наиболее стабильной.
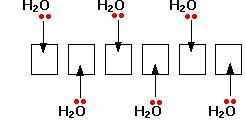
Пустые гибридные орбитали алюминия
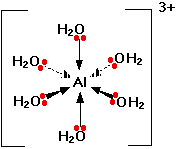
Только одна свободная электронная пара показана в каждой молекуле воды. Другая свободная пара расположена в противоположном направлении от алюминия и не вовлечена в образование связей. Получившийся ион выглядит подобным образом:
Дата добавления: 2015-11-20; просмотров: 2840;
