Термодинамика коррозии
В основе общих представлений о коррозии лежит тот факт, что большинство металлов (за исключением наименее активных, таких как Au и Pt) менее стабильны находясь в "несвязанном" состоянии в атмосферных условиях, чем находясь в виде ионов в химических соединениях.
Если рассмотреть процесс коррозии железа. Вероятность самопроизвольного прохождения процесса может быть оценена термодинамически:
H2O + Fe + 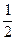 O2 = Fe(OH)2
O2 = Fe(OH)2
Если DG химической реакции меньше нуля, то процесс будет самопроизвольным (при постоянных температуре и давлении). Принимая во внимание, что DG=-nFE
и E = jc - ja » - joFe/Fe(2+) + joO2/OH(-)
где jc - потенциал катода, а ja- потенциал анода.
Если E>0 коррозия железа возможна с кислородной деполяризацией:
(A) Fe - 2e ® Fe2+
(C) O2 + H2O + 4e ® 4OH-
Если E>0 jM < jH2 коррозия металла возможна с водородной деполяризацией тоже:
(A) M - ne ® Mn+
(C) 2H+ + 2e ® H2
Электродный потенциал зависит от концентрации:
jH2 = joH2+ 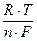 lncH+,
lncH+,
Поэтому коррозия с водородной деполяризацией во многих случаях происходит в кислой среде, но только активных металлов (которые стоят впереди H2 в ряду напряжений)
Kинетика коррозии
Коррозионный процесс является гетерогенным, поэтому кинетическое уравнение для гетерогенной реакции применимо для коррозии.
v = 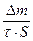 ,
,
гдe Dm - потеря массы,
S - площадь поверхности,
t - время.
Для процесса электрохимической коррозии:
Dm = k×q = k×I×t
v = 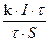 =
=  =
= 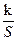 ×
× 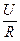 =
= 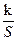 ×
× 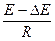
Скорость коррозии зависит oт:
-э.д.с. гальванического элемента (E);
-электродной поляризации (DE);
-сопротивления электролита (R).
Факторы влияющие на коррозию
1) Химическая природа металла (т.е. стандартный электродный потенциала)
2) Гетерогенность поверхности металла (что увеличивает э.д.с. микрогальванопар):
a) примеси в металле;
b) различие в температуре;
c) механические напряжения в металле;
d) механические дефекты поверхности металла;
e) различный контакт с электролитом
3) Свойства коррозионной среды:
a) электропроводность;
b) концентрация окислителя (O2, H+ и других);
c) способность растворять продукты коррозии.
Например, в нейтральной среде (pH=7) тонкая пленка Al2O3 защищает Al против коррозии:
Al2O3 +3H2O ¹,
но в щелочной среде коррозионный процесс алюминия имеет место:
Al2O3 +3H2O + 6NaOH = 2Na3[Al(OH)6]
и потом: Al + 3H2O = Al(OH)3 + 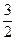 H2
H2
Al(OH)3+ 3NaOH =2Na3[Al(OH)6]
Дата добавления: 2015-11-20; просмотров: 1185;
