СТРОЕНИЕ ВЕЩЕСТВА. СТОЕНИЕ АТОМОВ
Структура атомов (особенно электронная конфигурация) очень важна в химии, поскольку от нее зависят свойства веществ.
В 1900г при исследовании некоторых особенностей спектров, M.Планк выдвинул постулат, что эмиссия электромагнитного излучения происходит не постоянно, а отдельными порциями. Причем существует наименьшее определенное количество этого излучения, которое равно:
e=h×n,
где h - элементарное количество излучения;
n - частота излучения.
Луи де Бройль в 1924 предположил, что свет имеет волновые свойства и свойства частицы (корпускулярно-волновой дуализм), материя в общем, и электрон, в частности, может проявлять как двойственные свойства. Используя уравнение Эйнштейна, если m - масса фотона:
e=m×c2,
гдe c - скорость света в вакууме (3×108 m/s)
применяя эти 2 уравнения:
m×c2 = h×n Þ m×c= 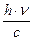 ; m×c- импульс фотона (p) and
; m×c- импульс фотона (p) and  =l (длина волны)
=l (длина волны)
p=m×c = 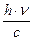 =
= 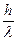 ; and l=
; and l= 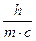
По де Бройлю, для частицы массой m, двигающейся со скоростью v, уравнение де Бройля имеет вид: l= 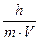
Экспериментальное доказательство волновых свойств электронов было получено американскими физиками Клинтоном Дэвиссом и Лестером Джермером (в 1927), и независимо Георгом Томпсоном (1927), которые наблюдали дифракцию при ускорении электронов. Уравнение, связывающее волновые характеристики с импульсом (mv) можно рассматривать как математическое выражение корпускулярно-волнового дуализма материи.
Концепция де Бройля по отношению к такой частице как электрон означает, что положение частицы (электрона) не может быть точно определено. В соответствии с принципом неопределенности выдвинутым немецким физиком-теоретиком Вернером Гейзенбергом в 1927, невозможно установить одновременно и точно и нахождение, и импульс электрона. Это относится и к другим подобным частицам. Если Dp и Dx представляет собой неопределенности импульса и положения частицы соответственно, тогда в соответствии с принципом Гейзенберга:
Dp×Dx³ 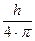
Де Бройль предположит, что частицы подобные электрону, характеризуются длиной волны, определяемую по уравнению де Бройля.
В 1926 австрийский физик-теоретик Эрвин Шрёдингер вывел дифференциальное уравнение для такой волновой функции:
- 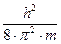 Ñ2y+U×y=E×y
Ñ2y+U×y=E×y
гдe Ñ2 = 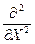 +
+ 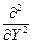 +
+ 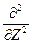 - оператор Лапласа (лапласиан).
- оператор Лапласа (лапласиан).
В этом уравнении известные величины:
m-масса частицы,
U-потенциальная энергия частицы как функции координат X,Y и Z.
h-постоянная Планка.
Неизвестные, которые определяются при решении уравнения:
E - величина возможной общей энергии частицы,
y - собственная волновая функция частицы.
Физический смысл y2 - это вероятность нахождения электрона в объеме, равном 1, и y2×dV - вероятность нахождения электрона в объеме dV окружающем точку, координаты которой известны.
Диаграмма, показывающая зависимость между вероятностью p(r) = 4pr2y2 и расстоянием r
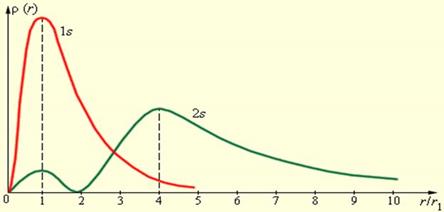
P(r) - вероятность нахождения электрона в сфере радиуса r. Показано 2 состояния атома водорода, где красная линия соответствует самому низкому уровню энергии.
Уравнение Шредингера имеет решения, только когда энергия равна определенным целым значениям. Точное решение этого уравнение найдено для очень простых атомов, таких как H, He+, Li+.
Квантовые числа
В результате решения уравнения получены квантовые числа: n, l, ml, ms, которые характеризуют энергию электрона в атоме в зависимости от ряда факторов. Найдено, что 4 квантовых числа необходимы, чтобы описать энергию электрона в атоме:
- главное (радиальное) квантовое число n;
- орбитальное квантовое число l;
- магнитное квантовое число ml (m);
- спиновое квантовое число ms (S).
Главное квантовое число было введено в теории Бора в 1913. оно описывает электронную оболочку, или энергетический уровень электрона в атоме. Волновая механика объясняет, почему только определенные электронные орбиты (оболочки) стабильны и могут размещать целое число волн (электронов). Если r - радиус круговой орбиты тогда стабильность орбиты может быть определена уравнением:
2×p×r = 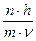 ,
,
гдe n - целое число. Это уравнение - математическое выражение первого постулата Бора, которое является основой его расчета движения электрона в атоме водорода в 1913.
Количество электронных оболочек в атоме равно номеру периода, в котором элемент располагается в Периодической Таблице.
Для перехода электронов из внутренней оболочки во внешнюю требуется внешняя энергия и этот переход может совершиться только в том случае если произойдет поглощение определенной частоты. Обратный переход сопровождается эмиссией электромагнитного излучения такой же частоты.
Oрбитальное квантовое число Спектральные линии, которые соответствуют переходу электрона с одного уровня на другой, состоят из нескольких отдельных близко расположенных линий (так называемая тонкая структура), показывающих что электроны данного энергетического уровня имеют различные энергии связи.
Энергия связи электрона в атоме определяется как энергия, необходимая для удаления электрона из атома.
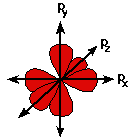
Электроны данного уровня (оболочки) соответственно разделены на подуровни, которым даны названия s, p, d, f. Принимая во внимание это различие в энергии связи, было введено второе квантовое число. Оно называется орбитальным (или азимутальным) квантовым числом l. Орбитальное квантовое число характеризует форму орбиталей. В соответствии с квантовой механикой, оно может принимать любое целое число от 0 дo (n-1), гдe n - главное квантовое числоr (0=s, 1=p, 2=d, 3=f). Буквы являются обозначением формы орбитали - s-орбиталь имеет сферическую симметричную формы по отношению к ядру атома. р-орбиталь похожа на два одинаковых вытянутых шара, соединенных вместе возле ядра атома. На любом энергетическом уровне возможно существование 3-х абсолютно эквивалентных p-орбиталей расположенных взаимно под прямым углом друг к другу (взаимно перпендикулярных). Этим орбиталям даны символы px, py и pz.
Maгнитное квантовое число В 1896 датский физик Питер Зееман наблюдал эффект расщепления спектральных линий на несколько компонентов в присутствии статического магнитного поля. Для объяснения этого явления было введено 3-е квантовое число. Оно называется магнитным квантовым числом ml (или m). Это число может иметь любое целое значение от -l до +l, включая 0.
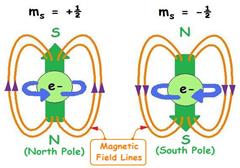
Спиновое квантовое число В 1920 Oтто Стерн и Уолтер Герлах проделали эксперимент который непреднамеренно привел к открытию, что электроны имеют свой собственный постоянный магнитный момент в то время как они движутся по орбитали вокруг атома. Эксперимент был проведен с серебром, которое испаряли и прпускали через магнитное поле. В результате наблюдали как электронный луч расщеплялся на 2. В 1925 Самюэль Годсмит и Джорж Ухленбек предположили что электроны ведут себя как если бы имели собственное вращение, и это стало объяснением эксперимента Стерна и Герлаха. Спин стали обозначать стрелкой вверх, если он равен +1/2, и стрелкой вниз, если он равен -1/2.
| Название | Символ | Физический смысл | Принимаемые значения | Примеры |
| Главное квантовое число | n | энергетический уровень (оболочка) | 1 ≤ n | n = 1, 2, 3, … |
| Орбитальное (азимутальное) квантовое число | ℓ | подуровень (s орбиталь обозначается как 0, p орбиталь - как 1 и.т.д.) | 0 ≤ ℓ ≤ n − 1 | для n = 3: ℓ = 0, 1, 2 (s, p, d) |
| Магнитное квантовое число, (проекция углового момента) | mℓ (m) | energy shift (oриентация подуровня) | −ℓ ≤ mℓ ≤ ℓ | для ℓ = 2: mℓ = −2, −1, 0, 1, 2 |
| спиновое квантовое число | ms(S) | спин электрона (−½ = "спин вниз", ½ = "спин вверх") | −s ≤ ms ≤ s | для электрона s = ½, so ms = −½, ½ |
"Принцип Паули (исключения или запрета)":
"Невозможно существование двух электронов в одном атоме, имеющих одинаковый набор всех четырех квантовых чисел"
или: "Если для двух электронов, находящихся на одной орбитали, n, l и ml одинаковы, то ms будет различным и электроны будут иметь противоположные спины.
Периодический закон:
Физические и химические свойства элементов и их соединений находятся в периодической зависимости от их атомного номера.
Периодическая система и электронная конфигурация
В периодической таблице элементы расположены в порядке возрастания их атомного номера в такой последовательности, что элементы с одинаковыми химическими и физическими свойствами объединены в группы. Поскольку свойства элементов зависят от их атомного номера и электронной структуры, каждая группа элементов имеет подобную электронную конфигурацию.
Запись электронной конфигурации основана на следующих правилах. Порядок заполнения орбиталей - принцип построения (Aufbau Principle):
1. Электроны располагаются на уровнях и подуровнях в порядке возрастания энергии. Электроны сначала заполняют орбитали с низшей энергией - ближе к ядру- затем, уровни и подуровни с более высоким значением энергии. На сравнительной энергетической диаграмме даны относительные значения энергий различных подуровней.
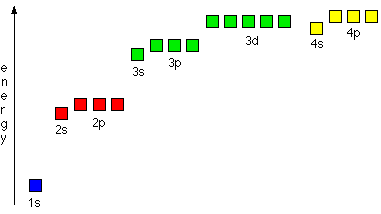
Такое заполнение происходит и в соответствии с Правилом Клечковского: Электроны заполняют уровни и подуровни в порядке возрастания (n+l), и если (n+l) - одинаково, то в порядке возрастания n.
2) Если есть "выбор" между орбиталями равной энергии, электроны заполняют орбитали "по одному" насколько это возможно (это правило называется Правилом Хунда). В случае "p" подуровней возможно три орбитали одинаковой энергии. Такие орбитали называются вырождеными. Также есть 5 и 7 вырожденых орбиталей для d и f подуровней соответственно. В соответствии с прравилом Хунда электроны занимают все такие орбитали, располагаясь там по одному с параллельными спинами. Это происходит потому, что в этом случае минимизируется энергия отталкивания между ними, и это делает атом более стабильным.
3) Электронная конфигурация элемента с любым атомным номером (за исключением атома водорода) может быть получена, если взять электронную конфигурацию предыдущего элемента (с атомным номером равным Z-1) и добавить один электрон на соответствующую орбиталь.
Электронную конфигурацию атома можно записать в виде короткой формулы:
1. цифра, соответствующая главному квантовому числу,
2. буква, обазначающая второе квантовое число, количество электронов на каждой соответствующей орбитали записывается как верхний индекс справа.
Например,
"Электронная" формула элементов 1-го периода:
атом водорода (H)- 1s1; гелия (He) - 1s2
2-го периода: бор (B) 1s22s22px1; кислород (O) 1s22s22px22py12pz1;
у неона весь второй уровень заполнен
3-го периода: магний (Mg) 1s22s22p63s2 (короткая запись) [Ne]3s2;
сера (S) 1s22s22p63s23px23py13pz1 (короткая запись) [Ne]3s23px23py13pz1
4-го периода: 4s уровень K и Ca заполнен, и в структура следующих атомов происходит постепенное заполнение 3d уровня. Таким образом, в зависимости от того какие s, p, d или f орбитали заполняются электронами, элементы периодической системы объединяют в блоки s-блок, p-блок, d-блок и f-блок:
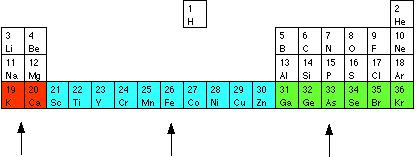
s блок d блок p блок
(заполнение (заполнение (заполнение
4s орбиталей) 3d орбиталей) 4p орбиталей)
У переходных элементов (d блок) с общей конфигурацией электронов (n-1)dnS (n³4) d подуровень не заполнен. Электроны nS уровня могут быть "перетянуты" на (n-1) уровень для заполнения d5 или d10 конфигурации (Cu, Au, Cr 1s22s22p63s23p63d54s1)
Потенциал ионизации (I). Минимальная энергия, необходимая для отделения и перенесения в бесконечность первого, наиболее близкого к ядру электрона, от нейтрального атома в его основном состоянии, называется первым потенциалом ионизации I1. Первый потенциал ионизации относится к процессу M ® M+ + e-. I2 и I3 относятся к процессам удаления 2-го и 3-го электронов соответственно.
Сродство к электрону (E). Сродство атома к электрону можно определить как энергию выделяющуюся при присоединении электрона к нейтральному атому в его основном состоянии, при этом атом становится отрицательно заряженным ионом.
Электроотрицательность (X). Электроотрицательность - это способность атома в молекуле смещать к себе общие электронные пары, т.е. притягивать к себе электроны других атомов.
Дата добавления: 2015-11-20; просмотров: 1090;
