Структура молекул и природа химической связи
Введение. Описание процесса образования молекул из атомов включает понятие валентность, которое тесно связано с электронной конфигурацией атомов. Побуждающей к образованию молекул силой является большая стабильность молекулы по сравнению с атомами, которые ее образовали. Небольшая реакционная активность инертных газов показывает, что атомы этих элементов достаточно стабильны; и эта стабильность связана с присутствием 8 электронов на их внешней оболочке, Исключением является только стабильная структура гелия, имеющего 2 электрона на первом уровне:
(He) - 1s2; (Ne) - 1s22s22p6
Электронный октет (8 электронов) рассматривается как исключительно устойчивая конфигурация. Один из постулатов электронной теории валентности тот, что насколько это возможно в процессе химического взаимодействия, каждый атом стремится достичь стабильного электронного октета. В зависимости от того, каким путем достигается этот октет, получается разные виды валентности.
Электровалентность и ионные соединения. А.Koссел и Г.Льюис (1916) независимо друг от друга предположили, что элементы непосредственно предшествующие инертным газам в периодической таблице являются электроотрицательными, а те, которые сразу следуют за инертными газами - электроположительными. Для достижения стабильной конфигурации элементам VII группы нужно присоединить один электрон, а элементам VI группы - 2 электрона. Для той же цели элементам I группы должны отдать один электрон, а II группы - отдать 2 электрона.
Na: 1s22s22p63s1 Na - 1e- = Na+ (1s22s22p6)
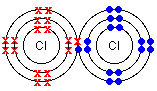
Cl: 1s22s22p63s23p5 Cl + 1e- = CL- (1s22s22p63s23p6)
Различие в электроотрицательности элементов, образующих противоположно заряженные ионы, огромно (DX>1.8), и как следствие, их атомы образуют ионную связь между собой. Если различие в электроотрицательности элементов равно нулю, образуется неполярная ковалентная связь; в промежуточном случае - образуется полярная ковалентная связь.
Ионная связь возникает между противоположно заряженными ионами, благодаря простому электростатическому притяжению между ними.
Ковалентная связь. Достижение электронной структуры благородных газов, кроме перемещения электронов, возможно путем совместного владения электронами, при этом образуется ковалентная связь. Может быть одна или более электронных пар, которые становятся общими для соединяющихся атомов.
Свойства ковалентной связи
1. Только атом с неспаренными электронами может принимать участие в образовании ковалентной связи
2. Ориентация связи. Для ковалентных связей, где s-электроны принимают участие, все направления равноправны, поскольку s-электронное облако имеет сферическую форму. Но p-электроны (и d-электроны) образуют связи, которые ориентированы в пространстве определенным образом друг к другу.
Рассмотрим на примере, что происходит в этом случае. Схема, которая показывает структуру молекулы метана:
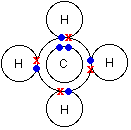
Электронная структура углерода 1s22s22px12py1, из которой видно, что присутствуют только 2 неспаренных электрона, которые могли бы участвовать в образовании связи с атомами водорода, вместо 4-х, которые присутствуют в молекуле метана СН4. Но в электронной конфигурации углерода только 2 p-электрона непосредственно могли бы образовать связь с водородом, почему не образовался метан с формулой CH2? На самом деле происходит перемещение электрона, и атом углерода переходит в возбужденное состояние:
переход электрона
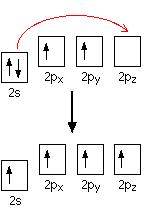
Когда происходит образование связей, высвобождается энергия и система становится более стабильной. Если углерод образует 4 связи вместо 2, в 2 раза больше энергии высвободится и в результате молекула будет стабильней.
После перемещения электрона все 4 неспаренных электрона готовы для образования связи. В молекуле метана все С-Н связи равноценны, но электроны атома углерода имеют различные s и р орбитали. На самом деле происходит реструктуризация электронных орбиталей углерода, которая называется гибридизацией. Реструктуризация электронных орбиталей в молекуле метана с образованием четырех идентичных гибридных орбитали называется sp3гибридизацией (потому что они являются результатом реорганизации одной s орбитали и трех p oрбиталей).
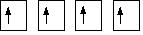
sp3 гибридные орбитали 
sp3 гибридные орбитали выглядят как
половинки p орбиталей, и они распологаются в пространстве как
можно дальше друг от друга.
3. Полярность связи. В результате различия в электроотрицательности 2-х атомов, между которыми образовалась ковалентная связь, электронная пара может быть распределена между ними не одинаково. Полярность молекулы (или связи) выражается количественно через ее дипольный момент (m), который равен произведению заряда на расстояние, разделяющее центры зарядов. Такая полярность воздействует на многие свойства молекул.
Дата добавления: 2015-11-20; просмотров: 1488;
