Двойной электрический слой и скачок потенциала
ЭЛЕКТРОХИМИЯ
Определения.
Электрический потенциал равен работе сил электрических полей по транспортировке единицы положительного заряда из данной точки в точку потенциал которой принят равным нулю.
Разность потенциалов между двумя точками равна работе необходимой для транспортировки единицы заряда из одной точки в другую.
Окисление представляет собой потерю электронов атомами или ионами вещества и которое становится окисленным:
Cu0 - 2e = Cu2+
Восстановление представляет собой присоединение электронов атомами или ионами вещества, которое становится восстановленным:
Fe3+ + e = Fe2+
Каждая реакция, сопровождающаяся переходом электронов, является единством двух противоположных процессов - окисления и восстановления. Поэтому такого рода реакции называются реакции окисления-восстановления или redox-реакции.
Cu0 + 2Fe3+ = Cu2++ 2Fe2+
Электролиз - это химический процесс, который происходит когда электрический ток проходит через раствор электролита или через расплавленный электролит.
Гальванический элемент - это любое устройство, которое вырабатывает электрический ток посредством химических реакций.
Двойной электрический слой и скачок потенциала
Давайте представим что металлическая пластина, например, железо, погружено в воду. Ионы железа подвергаются действию сильно поляризованных молекул воды и могут оторваться от поверхности металла и перейти в слой воды, примыкающий к поверхности металла.
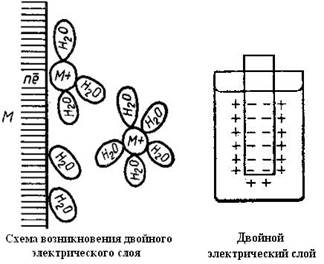
Fe - 2e Û Fe2+
Электростатическое притяжение, которое возникает между ионами железа, перешедшими в раствор, и противоположно заряженной металлической пластиной будет препятствовать дальнейшему процессу перехода в раствор ионов металла и установится равновесие. Разность потенциала возникнет между металлом пластины и окружающей его водной средой.

Двойной электрический слой и разность потенциала (скачок потенциала)
j - a разность потенциалов в двойном электрическом слое,
y - разность потенциала (скачок) в плотном слое
y' - разность потенциала (скачок) в диффузионном слое
Аналогичные эффекты наблюдаются, когда металл погружен не только в чистую воду, а и в раствор своей соли. Увеличение концентрации ионов металла будет способствовать переход ионов из раствора на поверхность металла, и равновесие установится при другом потенциале заряда металлической пластины. Более активные металлы, ионы которых имеют большую тенденцию переходить из раствора на поверхность металла становятся отрицательно заряженными (вариант а), а мeталлы неактивные (Сu, Ag и др.) ионы которых имеют небольшую тенденцию - положительно заряженными (вариант б):
Zn Ag
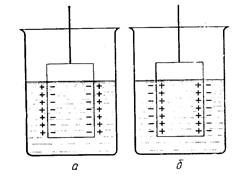
Положение равновесия зависит в первую очередь от соотношения энергий: энергии, необходимой для перевода иона из металла в раствор и энергии, необходимой для освобождения иона от гидратной оболочки.
Дата добавления: 2015-11-20; просмотров: 1916;
