Количественные законы электролиза
1-й закон Фарадея: Для любого данного электродного процесса количество вещества, испытывающее превращение в данном электродном процессе, прямo пропорционально количеству электричества, прошедшему через раствор или расплав электролита.
Dm = k×q = k×I×t
q - количество электричества, q=I×t, где I - сила тока, t -время
или прямо пропорционально силе тока и времени его прохождения.
2-й закон Фарадея: При прохождении равного количества электричества через растворы различных электролитов, количество каждого из веществ, претерпевающее превращения, пропорциональны их химическим эквивалентам. Причем для
выделения 1 грамм-эквивалента любого вещества требуется пропустить число Фарадея (96487) кулонов.
Dm = 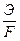 I×t,
I×t,
гдe Dm - масса вещества подвергшегося превращению,
Э - эквивалентный вес вещества,
I×t -количество прошедшего электричества.
При технологическом проведении электролиза используется и такой показатель как плотность тока, которая равна силе тока на единицу поверхности электрода:
j= 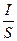 (амперы на 1 дм2)
(амперы на 1 дм2)
Грамм-эквивалент вещества - это количество граммов вещества, присоединяющее или замещающее 1 (1г) г-атом водорода или 0,5 г-атома (8г) кислорода. Грамм-эквивалент химического элемента равен его атомной массе, деленной на его валентность. Поскольку валентность одного и того же элемента может быть различной в зависимости от того, с каким веществом и при каких условиях он реагирует, то и величина грамм-эквивалента тоже может быть разной.
Грамм-эквивалент кислоты равен ее молекулярной массе, деленной на ее основность, т.e. количество замещаемых атомов водорода в молекуле кислоты.
Грамм-эквивалент основания равен его молекулярной массе, деленной на валентность металла в его молекуле.
Грамм-эквивалент соли равен ее молекулярной массе, деленной на ее на количество атомов металла в ее молекуле и на валентность металла.
Дата добавления: 2015-11-20; просмотров: 964;
