Работа 4. Неконкурентное ингибирование каталазы крови.
Метод основан на визуальном сравнении интенсивности выделения пузырьков газа / кислорода / при разложении пероксида водорода с участием каталазы крови в отсутствии и присутствии азида натрия.
В две пробирки вносят по 2 капли крови и добавляют в одну из них 2 капли воды, а в другую – такой же объём раствора азида натрия. Пробы встряхивают и добавляют по 2 капли Н2О2 в обе пробирки. Затем делают вывод о действии азида натрия на каталазу крови. Неконкурентными ингибиторами геминовых ферментов / цитохромксидаза, каталаза и пероксидаза / являются азиды и цианиды, которые взаимодействуют с железом гема, входящего в активный центр, подавляя тем самым каталическую активность этих ферментов.
Благодаря этому азиды и цианиды являются сильными ядами.
5. Методы обучения и преподавания:Беседа и устный опрос. Работа в малых группах. Тесты.
6. Литература:
Основная литература
7. Медициналық биохимия. Тапбергенов С.О., 2011г.
8. Медицинская клиническая биохимия. Тапбергенов С.О. Тапбергенов Т.С. 2009 г.
9. Медицинская и клиническая биохимия. Тапбергенов С.О. Тапбергенов Т.С. 2012 г.
10. Интерпретация клинико-биохимических анализов. Тапбергенов С.О. Тапбергенов Т.С. 2008 г.
11. Медициналық биохимия. Тапбергенов С.О. 2007 г.
12. Биологическая химия с упражнениями и задачами Под ред. С.Е.Северина. 2011 г.
Дополнительная литература
5. Руководство к практическим занятиям по биологической химии. Под ред. Тапбергенова С.О. 2012 г.
6. Биохимия. Под ред. Е.С.Северина. 2009 г.
7. Сеитов З.С. Биохимия : Өзгертіліп, толықтырылып үшінші рет басылып шығуы / З. С. Сеитов. - Алматы : "ЭВЕРО", 2012. - 570 с. : ил.
8. Биохимия сұрақтары мен жауаптары. Биохимия в вопросах и ответах: учебное пособие / Т. С. Сейтембетов, Б. И. Төлеуов. - Алматы : ТОО"ЭВЕРО", 2010 г.
7. КонтрольТекущий контроль. Проверка результатов выполнения заданий, самооценка и групповая оценка при работе на занятии, тестовые задания тестирование (тесты прилагаются).
Тестовый контроль по теме: «Ферменты».
1.Укажите свойства ферментов обусловленные их белковой природой?
1 -ускоряют обратную реакцию
2 -обладают термолабильностью
3 -активность зависит от рН среды
4 -чувствительны к воздействию активаторов и ингибиторов
5 -обладают специфичностью
2.Укажите, какие группировки остатков аминокислот могут формировать активные центры ферментов?
1 -SH -СООН -NН2
2 -S- -СООН -СН3
3 -NH2 -ОН -СН3
4 - S-S- -NH2
5 - ОН -SH -CH3
3. Укажите, какие из перечисленных соединений принимают участие в формировании активных центров ферментов?
1 НАД
2 ТПФ
3 ФП-СН=О
4 КоQ
5 веpно все
4. Чем объснить, что многие ферменты снижают свою активность выше 45 градусов по Цельсию?
1 -белковая молекула фермента денатурируется
2 -возможен распад первичной структуры фермента
3 -обратимо меняется третичная структура фермента
4 -снижается энергия активации фермента
5 -разрушается кофермент
5.Что происходит при активации пепсиногена до пепсина?
1 -происходит денатурация
2 -происходит структурная реорганизация пепсиногена с отщеплением пептида
3 -происходит присоединение кофермента
4 -происходит формирование вторичной структуры пепсина
5 -происходит изменение третичной структуры пепсина
6.Что происходит при конкурентном ингибировании сукцинатдегидрогеназы малоновой кислотой?
1 -изменение третичной структуры фермента
2 -ингибирование продуктами реакции
3 -обратимое ингибирование
4 -угнетение в зависимости от концентрации ингибитора
5 -обратимое ингибирование зависимое от концентрации ингибитора
7.Что происходит при аллостерическом ингибировании любого фермента в т. ч. и цитратсинтетазы?
1 -ингибирование продуктами реакции
2 -изменение третичной струтуры фермента
3 -обратимое ингибирование продуктами реакции или другими метаболитами
4 -обратимое конкурентное ингибирование
5 - необратимое ингибирование и изменение третичной структуры фермента
8.Что присходит при связывании цианидов с активным центром гемсодержащих ферментов?
1 -необратимое ингибирование
2 -изменение третичной структуры фермента
3 -ингибирование, не связанное с концентрацией ингибитора
4 -необратимое ингибирование не связанное с концентрацией ингибитора
5 -веpно 1 и 2
9.Что происходит при действии сульфаниламидов на бактерий, поглотивщих эти соединения?
1 -изменение структуры коферментов производных фоливой кислоты
2 -изменение первичной и вторичной структуры дегидрогеназ
3 -изменение структуры митохондрий бактекий
4 -ингибирование оксидоредуктаз бактерий продуктами реакции
5 -нарушение структуры мембран лизосом бактерий
10. Как называется белковая часть двукомпонентных ферментов?
1 апофермент или апоэнзим
2 апоэнзим или холофеpмент
3 кофермент или апофеpмент
4 коэнзим или апоэнзим
5 кофактор или пpотеин
11. Какой витамин входит в состав ТПФ ?
1 рибофлавин
2 ниацин
3 пантотеновая кислота
4 цианкобламин
5 аневрин
12. Какой витамин входит в состав КоА ?
1 рибофлавин
2 тиамин
3 пантотеновая кислота
4 фолиевая кислота
5 биотин
13.Назовите кофермент формула которого вам представлена:
CН2-СН2-CН-(-СН2)4-СООН
| |
S----------S
1 пантотеновая кислота
2 рибофлавин
3 глютатион
4 убихинон
5 липоевая кислота
14. Формула какого кофермента изображена на рисунке ?
O
║ СН3 СН3
Н3С-О _ / \ _СН3 | |
Н3С-О _║ ║__(СН2-СН=С-СН2-)9-СН2-СН=С-СН3
\ /
║
О
1 пантотеновая кислота
2 рибофлавин
3 глютатион
4 убихинон
5 липоевая кислота
15. Производное какого витамина этот кофермент?
Н-С=О ОН
| |
НО__ / \\__CH2-О-Р=О
Н3С__|| | |
\ // ОН
N
1 В2
2 В3
3 РР
4 В1
5 В6
16.Перед вами формула одного из коферментов. Структура какого витамина в нем представлена?
NН2
|
 OH OH
OH OH

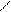
 N СН2_+N__CH3 | |
N СН2_+N__CH3 | |
|| ||_____CН2-СН2-О-Р-О-Р=О
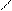
 \ / || |
\ / || |
H3C S О ОН
N
1 В1
2 В2
3 РР
4 В3
5 В6
17.Какое свойство ферментов изображено на этом графике?
V
¦ ___________
 Vmax ¦
Vmax ¦
¦
¦____¦______________( S )
¦
1/2Smax
1- чувствительность к действию активаторов
2- чувствительность к действию ингибиторов
3- чувствительность к концентрации субстрата
4- чувствительность к концентрации фермента
5- чувствительность к температуре
18.Какое свойство ферментов можно изобразить этим графиком?
Vmax
¦ / \
¦ / \
¦ / \
¦/_______\__( ? )
1- чувствительность к действию активаторов и температуре
2- чувствительность к действию ингибиторов и рН
3- чувствительность к концентрации субстрата и активаторов
4- чувствительность к концентрации фермента и субстрата
5- чувствительность к температуре и рН
19.Как можно избавиться от ингибиpующего действия конуpентного ингибитоpа?
1 добавить активатоp
2 повысить концентpацию субстpата
3 понизить темпеpатуpу
4 изменить pH сpеды
5 повысить темпеpатуpу
20.Выбеpите наиболее хаpактеpный пpизнак аллостеpических феpментов:
1 -это олигомеpы, состоящие из 2 и более мономеpов
2 -они существуют в двух взаимосвязанных фоpмах- активной и неактивной
3 -они имеют кpоме активного и аллостеpический центp
4 -они имеют только аллостерический центр
5 -они не реагируют на аллостерические эффекторы
21.Ферменты по химической природе являются:
1 углеводами
2 белками специализированными
3 белками неспециализированными
4 неорганическими катализаторами
5 аминокислотами
22. Ферменты - биологические катализаторы, которые:
1 обладают меньшей мощностью действия, чем неорганические катализаторы
2 ускоряют реакции независимо от условий среды
3 входят в состав конечных продуктов
4 могут действовать на любой субстрат
5 обладают большей мощностью действия, чем неорганические катализаторы
23. Активный центр однокомпонентного фермента образован:
1 функциональными группами аминокислот
2 витаминами
3 нуклеиновыми кислотами
4 различными металлами
5 моносахаридами
24. Каталитический участок активного центра фермента обеспечивает:
1 узнавание субстрата и связывание с ним
2 характер катализируемой реакции
3 взаимодействие фермента с продуктом реакции
4 формирование аллостерического центра
5 образование фермент-субстратного комплекса
25. Температурный оптимум - это температура, при которой:
1 наблюдается обратимая инактивация
2 фермент обладает минимальной активностью
3 фермент осаждается
4 фермент проявляет максимальную активность
5 фермент не активен
26. Оптимум рН для действия пепсина лежит в области:
1 4,5-5,0
2 1,5-2,0
3 10,0
4 7,5-8,0
5 6,9-7,0
Код к тестам:
1. 2
2. 1
3. 5
4. 1
5. 2
6. 5
7. 3
8. 4
9. 1
10. 1
11. 5
12 3
13. 5
14. 4
15. 5
16. 1
17. 3
18. 5
19. 2
20. 3
21.2
22. 5
23. 1
24. 2
25. 4
26. 2
Дата добавления: 2015-09-11; просмотров: 1343;
