Атом водорода в квантовой механике.
Квантовые числа
Атом – наименьшая частица вещества, обладающая всеми химическими свойствами элемента. Простейшим атомом является атом водорода, состоящий из одного протона и одного электрона.
Рассмотрим движение электрона в кулоновском поле ядра с зарядом 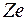 . При Z=1 такая система соответствует атому водорода, при иных Z – водородоподобному иону. Водородоподобными ионами принято называть ионы
. При Z=1 такая система соответствует атому водорода, при иных Z – водородоподобному иону. Водородоподобными ионами принято называть ионы 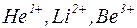 , имеющие ядро с зарядом
, имеющие ядро с зарядом 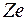 и один электрон.
и один электрон.
Потенциальная энергия электрона зависит от его расстояния от ядра и определится формулой
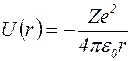 . (1.8.1)
. (1.8.1)

Эта зависимость представлена графически на рис.1.12. Поэтому принято говорить, что электрон в водородоподобном атоме находится внутри гиперболической центрально-симметричной потенциальной ямы.
Запишем уравнение Шредингера для этого случая
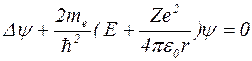 . (1.8.2)
. (1.8.2)
Здесь 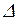 - оператор Лапласа. Так как потенциальная яма имеет центрально- симметричную форму, то оператор Лапласа необходимо взять в сферической системе координат:
- оператор Лапласа. Так как потенциальная яма имеет центрально- симметричную форму, то оператор Лапласа необходимо взять в сферической системе координат: 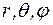 и волновые функции в общем случае будут зависеть от координат
и волновые функции в общем случае будут зависеть от координат 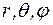 . Данная задача успешно решена в квантовой механике, но решение ее достаточно громоздкое, и мы его здесь не приводим. Рассмотрим лишь основные результаты, которые следуют из решения уравнения (1.8.2).
. Данная задача успешно решена в квантовой механике, но решение ее достаточно громоздкое, и мы его здесь не приводим. Рассмотрим лишь основные результаты, которые следуют из решения уравнения (1.8.2).
Уравнение (1.8.2 ) имеет решение в следующих случаях:
§ при любых положительных значениях энергии электрона E>0. Этот случай соответствует свободному электрону, не связанному с атомом;
§ при дискретных отрицательных значениях энергии
 , (n = 1, 2, 3….). (1.8.3)
, (n = 1, 2, 3….). (1.8.3)
Значения 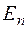 называют собственными значениями.
называют собственными значениями.
Собственные функции уравнения содержат 3 целочисленных параметра. Их называют квантовыми числами и обозначают n, l, m.
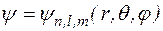 . (1.8.4)
. (1.8.4)
Параметр n называется главным квантовым числом. Оно определяет энергию электрона в атоме и может принимать любые целочисленные значения. Энергия электрона в атоме квантуется.
Число l называется орбитальным квантовым числом. При данном n оно может принимать значения: l =0, 1, 2…. , n -1 (всего n значений).
Орбитальное квантовое число l определяет возможные значения момента импульса электрона L
 . (1.8.5)
. (1.8.5)
Момент импульса электрона квантуется.
Различные значения орбитального квантового числа электрона служат для систематики электронных состояний в атомах и молекулах. Приняты следующие обозначения:
l=0 – s –состояние;
l =1 – p –состояние;
l =2 – d –состояние;
l =3 – f –состояние.
Значение главного квантового числа указывается перед условным обозначением квантового числа l. Возможны следующие состояния электрона:
1s,
2s, 2p,
3s, 3p, 3d,
4s, 4p, 4d, 4f и т.д.
Число m называется магнитным квантовым числом. При заданном l магнитное квантовое число может принимать значения:
ml=0, ±1, ±2, ….,±l, (всего 2l +1 значение).
Магнитное квантовое число определяет возможные значения проекции орбитального момента импульса на направление внешнего магнитного поля. Это означает, что существует пространственное квантование: вектор момента импульса 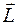 может иметь только вполне определенные дискретные ориентации в пространстве. Проекция момента импульса на направление Z может принимать значения
может иметь только вполне определенные дискретные ориентации в пространстве. Проекция момента импульса на направление Z может принимать значения
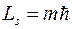 (1.8.6)
(1.8.6)
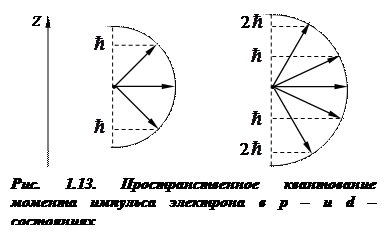
На рис.1.13 показано пространственное квантование вектора 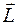 для электронов в p– и d– состояниях.
для электронов в p– и d– состояниях.
Различные состояния атома с одинаковой энергией называются вырожденными, а число состояний с одинаковой энергией называется кратностью вырождения. Число различных состояний соответствующих данному n и различным l и m можно рассчитать по формуле
 . (1.8.7)
. (1.8.7)
Таким образом, каждый уровень энергии атома водорода имеет вырождение кратности n2. В таблице 1.2 приведены состояния, соответствующие первым трем энергетическим уровням.
Таблица 1.2.
Дата добавления: 2015-11-10; просмотров: 1588;
