Спектр атома водорода
Изобразим схему уровней энергии атома водорода (рис.1.16).
Испускание и поглощение света происходит при переходе электрона с одного энергетического уровня на другой. В квантовой механике доказывается, что наиболее вероятны (возможны) только такие переходы, при которых изменение квантового числа l равно
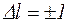 . (1.11.1)
. (1.11.1)
Это условие называется правилом отбора.
При переходе электронов излучается квант энергии, равный
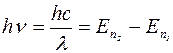 . (1.11.2)
. (1.11.2)
Здесь 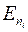 - энергия уровня, соответствующего значению главного квантового числа ni , ν – частота, λ – длина волны излучения. Формулу (1.11.2) можно представить в виде
- энергия уровня, соответствующего значению главного квантового числа ni , ν – частота, λ – длина волны излучения. Формулу (1.11.2) можно представить в виде
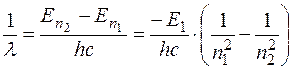 , (1.11.3)
, (1.11.3)
где 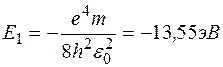 .
.

Группа спектральных линий с одинаковыми n1 называется серией. Назовем некоторые серии линий спектра атомов водорода:
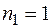 – серия Лаймана, она находится в ультрафиолетовой части спектра.
– серия Лаймана, она находится в ультрафиолетовой части спектра.
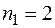 – серия Бальмера, она находится в видимой части спектра.
– серия Бальмера, она находится в видимой части спектра.
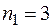 - серия Пашена, она находится в инфракрасной части спектра.
- серия Пашена, она находится в инфракрасной части спектра.
На рис.1.16 изображены электронные переходы, соответствующие сериям Лаймана (1) и Бальмера (2) с учетом правил отбора(1.11.1).
Формулу (1.11.3) можно записать в виде
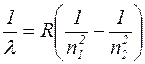 , (1.11.4),
, (1.11.4),
где 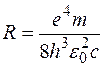 . (1.11.5)
. (1.11.5)
Выражение (1.11.4) называется сериальной формулой. Величина R называется постоянной Ридберга; ранее она была установлена экспериментально; ее численное значение равно 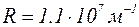 , что совпадает с вычисленным по формуле (1.11.5).
, что совпадает с вычисленным по формуле (1.11.5).
Дата добавления: 2015-11-10; просмотров: 1004;
