E. M. Donaldson, P.Swanson, W.-K. Chan. 3 страница
Для определения хромосомной локализации гена, ответственного за доброкачественные семейные судороги новорожденных (BFNC, benign familial neonatal convultions), была изучена большая семья, представленная несколькими поколениями, члены которой страдали данным заболеванием (рис. 20.16). Это состояние проявляется приступами неконтролируемых подергиваний мышц лица, туловища, рук и ног в первые шесть месяцев жизни. Примерно в 90% случаев симптомы исчезают после 1 года. По-видимому, припадки не оказывают влияния на неврологический и интеллектуальный статус. BFNC — редкое заболевание, которое имеет четкие клинические признаки, наследуется по аутосомнодоминантному типу и имеет высокую пенетрантность.
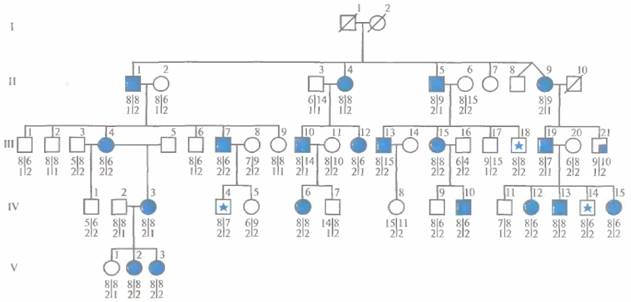
В исследованной родословной, включающей несколько поколений, два из всех протестированных полиморфных маркеров, D20SI9 и D20S20, были сцеплены с локусом BFNC (табл. 20.4; рис. 20.16). Аллели локусов D20S19 и D20S20 каждого генотипированного члена родословной, представленной на рис. 20.16, обозначены числами, расположенными одно над другим. Верхние числа соответствуют аллелям локуса D20SI9, нижние - D20S20. Вертикальная черта разделяет аллели локусов одной хромосомы.
С помощью зонда D20S19 было выявлено 10 аллелей ПДРФ-локуса, с помощью зонда D20S20 - 2 аллеля. В некоторых ПДРФ-локусах несколько сайтов узнавания для одной рестрик-тазы группируются на небольшом сегменте ДНК (примерно 20 т. п. н.) и все вместе рассматриваются как один локус. Четыре близкорасположенных сайта для одной рестриктазы могут приводить к образованию 20 фрагментов разной длины, которые выявляются одним зондом. STRP-локусы также могут иметь более двух аллелей.
Молекулярная генетика человека 457
|
| Рис. 20.16. Анализ гаплотипов двух хромосом по 20 полиморфным локусам в родословной, члены которой больны BFNC. Числа под символами - аллели двух полиморфных локусов, D20S19 и D20S20 (верхние и нижние числа соответственно). Гаплотипы двух хромосом индивидуума разделены вертикальной чертой. Перечеркнутые символы соответствуют умершим индивидам, цветные — липам, страдающим данным заболеванием. Символ с закрашенной четвертью квадрата отвечает случаю, когда «клинический» фенотип индивида отличался от фенотипов других больных членов семьи. II-8 и II-9 - неидентичные (разнояйцевые) близнецы. Символами со звездочкой отмечены случаи возможного проявления неполной пенетрантности (III-18, IV-4, IV- 14). У больных членов семьи обнаруживается косегрегация гаплотипа (8,2) с заболеванием, все они несут эту хромосому, унаследованную от общего предка. (По данным работы Leppert et al., Nature [London] 337: 647-64S, 1989.) |
Среди членов представленной на рис. 20.16 родословной в большинстве случаев наблюдается косегрегация гаплотипа (8,2) с заболеванием; это позволяет предположить, что в данной семье локус BFNC находится именно на хромосоме 8,2. Можно было ожидать, что и индивиды III-18, IV-4 и IV-14, получившие от больного родителя хромосому (8,2), также будут больны, однако это предположение не подтвердилось. Возможно, эти исключения связаны с неполной
| Таблица 20.4. Двухлокусный лод-балл для локуса BFNC и двух полиморфных локусов хромосомы 201) | ||||||
| JIoкус | Рекомбинационный индекс, θ | |||||
| 0,00 | 0,03 | 0,10 | 0,20 | 0,30 | 0,40 | |
| D20S20 | 3,12 | 3,05 | 2,88 | 2,32 | 1,57 | 0,69 |
| D20S19 | 2,87 | 2,92 | 2,83 | 2,36 | 1,63 | 0,76 |
| 1) По данным работы Leppert el al., Nature (London) 337: 647-648, I989, |
пенетрантностью заболевания. Другими словами, у индивидов III-18, IV-4 и IV-14 есть ген BFNC, но он не экспрессируется. Аналогичные случаи при анализе сцепления других заболеваний могут обусловливаться ошибками в диагностике или тем, что у некоторых индивидов, несущих ген заболевания, симптомы еще не проявились.
В нескольких случаях дети родителя, больного BFNC, несут хромосому (8,2) (например, IV-7 и IV-11), но никаких симптомов заболевания у них не обнаруживается. В обоих упомянутых выше случаях можно определить происхождение данной хромосомы. Например, индивид IV-7 унаследовал хромосому (14,1) от больного отца, а хромосому (8,2) с нормальным геном BFNC — от здоровой матери. Сложнее объяснить генотипы индивидов IV-9 и V-1. С одной стороны, они могли получить хромосому (8,2) с нормальным геном BFNC от здоровых предков.
458 ГЛАВА 20

|
| Построение генетической карты сцепления человека с помощью метода, основанного на полиморфизме длины рестрикционных фрагментов |
| D. Botstein, R. L. Whire, M. Skolnick, R. W. Davis Am. J. Hum. Genet. 32: 314-331, 1980 |
| Часто встречающиеся типы полиморфизма у человека, которые можно типировать с помощью полимеразной цепной реакции |
| J. L. Weber, Р. Е, May Am. J. Hum. Genet.44; 388-396. 1989 |
| Бурное развитие молекулярной генетики человека, начавшееся в 1980-х гг., стало возможным благодаря новаторским идеям Д. Ботштейна, Р. Уайта, М. Сколника и С. Дэвиса. Они обратили внимание, что полиморфизм длины рестрикционных фрагментов (ПДРФ) человека порождает полиморфные аллели (маркерные локусы), поддающиеся картированию. Как писали авторы в своей статье, «мы хотим предложить новый способ построения генетической карты сиепления человека, В его основе лежит создание при помощи технологии рекомбинантных ДНК случайных однокопийных ДНК-зондов, способных выявлять полиморфные нуклеотидные последовательности при гибридизации с индивидуальными ДНК, обработанными рестриктазой». Более того, они осознали, что, используя сцепление гена того или иного заболевания с маркерным локусом, можно определить хро- | мосомную локализацию этого гена. Эта идея не была высказана ими прямо, но она непосредственно вытекала из их концепции, Ботштейн и др, пришли к абсолютно верному выводу: «Применение набора зондов, специфичных в отношении полиморфных участков ДНК, для анализа ДНК членов родословных с большим числом поколений откроет новые горизонты в генетике человека». К 1992 г, на разных хромосомах человека были идентифицированы и картированы сотни ПДРФ- маркеров. С их помощью были изолированы гены таких наследственных заболеваний, как миодистрофия Дюшенна и муковисцидоз. К сожалению, выcокополиморфные локусы расположены на разных хромосомах человека неравномерно и не всегда на близком расстоянии друг от друга. Кроме того, ПДРФ-анализ, основанный на гибридизации зонда с | рестрицированной ДНК, весьма трудоемок и часто дает ошибочные результаты. Все эти проблемы удалось решить, когда Вебер и Мэй обнаружили, что по всему геному человека разбросано множество высокополиморфных ди-, три- и тетрануклеотидных повторов (коротких тандемных повторов; STS, от англ, short tandem repeats), вариации которых легко различаются при помощи ПЦР, Как писали авторы, «...данный тип полиморфных последовательностей, вероятно, найдет широкое применение при изучении многих генов наследственных заболеваний и позволит значительно увеличить разрешение генетических карт человека», STR, особенно динуклеотидные тандемные повторы, эффективны как маркеры; в этом качестве они уже вытеснили ПДРФ-локусы и в настоящее время используются для построения подробных генетических карт всех хромосом человека. |
Например, индивид IV-9 мог унаследовать хромосому (8,2) через свою мать (III-15) от бабушки (II-6). С другой стороны, отсутствие у IV-9 и V-1 признаков заболевания может объясняться неполной пенетрантностью в том случае, если они унаследовали хромосому (8,2) с геном BFNC*D от больного родителя. Необходимо подчеркнуть, что в других семьях с BFNC может не наблюдаться сцепления аллелей D20S19*S и D20S20*2 саллелем данного заболевания. Так получилось, что в рассмотренном нами случае именно эти полиморфные аллели находятся на той же хромосоме, которая несет аллель BFNC*D и которая унаследована от одного предка. В общем случае сцеплены локусы, а не аллели.
Из данных табл. 20.4 можно предположить, что расстояние от локусов D20SI9 и D20S20 до локуса BFNC не превышает 5 сМ (<5 · l06 п. н.). В общем случае анализ сцепления не позволяет разграничить два локуса, если расстояние между ними меньше 1—2 сМ, Поскольку локусы D20S19 и D20S20 расположены внутри района 13.2—13.3 длинного плеча (q) хромосомы 20
Молекулярная генетика человека 459
(20q13.2-13.3), то и локус BFNC должен находиться вблизи данного района хромосомы или внутри него. К настоящему времени при помощи метода, основанного на вычислении лод-балла и использовании полиморфных маркеров, в специфических хромосомных участках было картировано более ста генов различных заболеваний.
Построение мультилокусных хромосомных карт человека
Использование многих тысяч разбросанных по всему геному полиморфных маркеров позволило определять как порядок расположения локусов, так и расстояния между ними на каждой хромосоме. Карта сцепления полиморфных участков оказывается неоценимой при локализации генов различных заболеваний. Для идентификации таких генов можно использовать зонды, специфичные в отношении последовательностей, которые фланкируют данный ген.
Идеальными для картирования полиморфных локусов являются семьи, представленные тремя поколениями, в которых живы обе прабабки и оба прадеда, а родители имеют большое число детей (>8). Исходя из генотипов бабок и дедов, можно установить генетическую фазу, в которой находятся исследуемые локусы у каждого из родителей, а наличие большого числа детей повышает вероятность того, что рекомбинация произойдет. В Центре по изучению полиморфизма человека (СЕРН, Centre d'Etude du Polymorphisme Humain) в Париже собраны данные и образцы ДНК членов 65 семей, представленных в большинстве случаев тремя поколениями и имеющих в среднем по 8,5 детей (см., например, рис. 20.17). Этот банк семей (СЕРН-семей) предоставляет информацию о генотипах
всех членов лабораториям всего мира, занимающимся картированием. В действительности он состоит из культур лимфобластозных клеточных линий большинства членов СЕРН-семей и служит готовым источником ДНК для картирования новых полиморфных локусов по мере их обнаружения.
Построение мультилокусной генетической карты (карты сцепления) хромосомы человека — непростая задача; для ее решения используют специализированную комьютерную программу, позволяющую установить порядок расположения локусов, наилучшим образом согласующийся с данными по рекомбинациям. Проблема упорядочивания локусов усложняется по мере возрастания числа локусов, которые необходимо картировать. Для N локусов существует N!/2 возможных вариантов их расположения. Так, для 10 локусов их число равно 1 814 400. И хотя некоторые комбинации заведомо нереальны, даже если основываться на визуальной проверке данных, все же число возможных вариантов остается очень большим. Обычно сначала находят наиболее вероятное расположение нескольких сцепленных локусов, а затем комбинируют эти «наилучшие» варианты и строят статистически достоверную карту сцепления всех локусов. Критерием того, расположен ли один локус рядом с другим, является значение десятичного логарифма правдоподобия (лод-балла); если он равен или превышает +3,00, то ответ будет положительным.
В общем случае построение карты проводят поэтапно. Сначала отбирают несколько полиморфных маркеров, расположенных на одной хромосоме. Потом генотипируют образцы ДНК, полученные от нескольких СЕРН-семей, по каждому полиморфному маркеру. Структура СЕРН-семей такова, что нет необходимости в
| Рис. 20.17. СЕРН-семья К1331. | 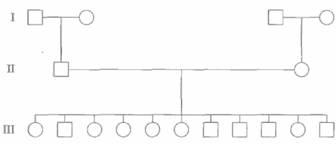
|
460 ГЛАВА 20
определении генотипов всех образцов ДНК. Привлечение других семей не дает повышения качества карты, которое оправдывало бы дополнительную работу. Обычно используют 15, иногда — 40 семей. Для генотипирования 40 СЕРН-семей по 20 полиморфным маркерам необходимо провести примерно 10 000 анализов. Генотип каждого индивида по каждому локусу вводят в базу данных. На этом этапе происходит проверка базы данных на предмет ошибок. Компьютерная программа проводит поиск случаев несоответствия генотипов родителей и детей; эти ошибки возникают во время введения данных или генотипирования. Иногда для уточнения полученных результатов проводят повторное типирование. Ошибки могут приводить к неправильным выводам о расположении локусов и расстояниях между ними. Ошибочные данные по возможности исключаются из анализа. Для генотипированных СЕРН-семей определяют все «двухлокусные» лод-баллы и рекомбинационные индексы (θ), и исходя из этих данных конкретная компьютерная программа строит генетическую карту (карту сцепления).
Карты сцепления хромосом человека постоянно обновляются по мере идентификации дополнительных полиморфных локусов. С увеличением числа локусов повышается разрешение карты и уменьшается расстояние между локусами. К 1994 г. были определены генотипы членов СЕРН-семей примерно по 6000 полиморфным маркерам и с помощью мультилокусного картирования установлено положение примерно 1000 локусов по всему геному человека со средним расстоянием между локусами около 4 сМ. Задача широкомасштабных проектов картирования состоит в том, чтобы, используя дополнительные полиморфные маркеры, построить карту каждой хромосомы с расстоянием между локусами 1—2 сМ.
Локализация гена заболевания на карте сцепления
Для решения этой задачи проводят генотипирование членов семей с определенным генетическим заболеванием по полиморфным маркерам, которые, по данным картирования, находятся на том же плече хромосомы, что и ген заболевания. Используют те же подходы, что и при вычислении двухточечного лод-балла при анализе
сцепления. В данном случае локус гена заболевания произвольно размещают среди четырех упорядоченных локусов и вычисляют лод-балл для каждой позиции. В случае мультилокусного картирования лод-балл равен логарифму отношения 1) вероятности того, что ген заболевания занимает определенное положение на карте из четырех упорядоченных локусов, к 2) вероятности того, что ген заболевания не сцеплен ни с одним из рассматриваемых полиморфных локусов. Использование именно четырех полиморфных локусов обусловлено тем, что при большем их числе слишком сильно усложняются расчеты. Ген заболевания может располагаться до первого локуса, в разных областях между локусами или за последним локусом. Рассчитав лод-балл для каждого положения гена, которое он может занимать в различных наборах из четырех локусов, выбирают максимальное его значение, превышающее +3,00; оно дает наиболее вероятную локализацию данного гена.
Картирование с использованием радиационных гибридов
Для картирования с использованием радиационных гибридов (РГ-картирования) не нужно собирать родословные и генотипировать членов банка СЕРН-семей. В основе метода лежит работа с соматическими клетками и скрининг (с использованием ПЦР-зондов) клеточных линий, содержащих части (фрагменты) хромосом человека. PГ-картирование целой хромосомы или какой-то ее области начинается с создания гибридной (человек/грызун) клеточной линии, содержащей одну хромосому человека. Клетки такой монохромосомной гибридной клеточной линии подвергают воздействию летальных доз ионизирующей радиации (рентгеновских или гамма-лучей), в результате чего разрушаются клеточные мембраны, инактивируются ферменты, происходит фрагментация хромосом. Единицей измерения дозы ионизирующего излучения, поглощенной биологическим объектом, является рад (rad, от англ, radiation absorbed dose). Один рад равен 0,01 Дж на 1 кг ткани или 100 эргам на 1 г ткани. Обычно клетки в культуре погибают при 3000 рад. Чем больше доза, тем более сильные повреждения возникают и тем меньше размер образующихся фрагментов
Молекулярная генетикачеловека 461
ДНК, При дозе 10 000 рад фрагменты слишком малы для РГ-картирования.
Очень важным моментом при РГ-картировании является высвобождение и сохранение фрагментов ДНК человека, полученных после облучения. Чтобы решить эту задачу, проводят слияние облученных (донорских) клеток с необлученными (реципиентными) клетками грузынов. Облученные клетки, слившиеся друг с другом или оставшиеся изолированными, не способны расти в культуре вследствие радиационных повреждений. В свою очередь, реципиентные клетки, как слившиеся друг с другом, так и не слившиеся, лишены селективного маркера, который присутствует в донорских клетках и обеспечивает их рост в куль-туральной среде, используемой для слияния. Следовательно, в данной среде будут пролиферировать лишь слившиеся клетки донор—реципиент, несущие селективный маркер, при этом большинство фрагментов ДНК облученных клеток окажутся встроенными или транслоцироваиными на функциональные хромосомы реципиентных клеток. Выжившие слившиеся клетки культивируют вместе до тех пор, пока не установятся отдельные клеточные линии — так называемые радиационные гибриды {РГ)· Группу радиационных гибридов, полученных в результате одного эксперимента, называют панелью радиационных гибридов (РГ-панелью). В ней в виде фрагментов хранится большая часть хромосомной ДНК человека, полученной из монохромосомной клеточной гибридной линии.
| Таблица 20,5. Данные по сохранению маркеров при РГ-картировании 1) | |||||||
| РГ-панель | Наличие или отсутствие маркера | ||||||
| А. | Б | В | Г | Д | Е | Ж | |

| 
| 
| 
| 
| 
| 
| |
| 
| 
| 
| 
| 
| 
| |

| 
| 
| 
| 
| 
| 
| |

| 
| 
| 
| 
| 
| 
| |

| 
| 
| 
| 
| 
| 
| |
| 
| 
| 
| 
| 
| 
| |

| 
| 
| 
| 
| 
| 
| |

| 
| 
| 
| 
| 
| 
| |
| 
| 
| 
| 
| 
| 
| |

| 
| 
| 
| 
| 
| 
| |
| 1) Номера и буквы - радиационные гибриды и ПЦР-маркеры соответственно. Знаки плюс и минус указывают наличие или отсутствие маркерных сайтов в дачном радиационном гибриде |
ДНК каждого члена РГ-панели анализируют с помощью нескольких хромосомоспецифичных ПЦР-зондов, многие из которых «узнают» полиморфные участки. Однако полиморфизм как таковой не требуется для РГ-картирования. Цель такого картирования — выяснить, присутствует ли данный участок хромосомы в клеточных линиях РГ-панели. Следовательно, для скрининга можно использовать и ПЦР-праймеры, специфичные в отношении уникальных (однокопийных) последовательностей ДНК. Мономорфные ПЦР-идентифицируемые хромосомоспецифичные участки называют ДНК-маркирующими сайтами (STS, от англ, sequence tagged sites). Все клеточные линии РГ-панели проверяют на наличие (+) или отсутствие (—) такого сайта (табл. 20.5), используя весь набор зондов, и гибриды,
ДНК которых не амплифицируется, отбраковывают. Для эффективного РГ-картирования необходима панель примерно из 100 РГ, полученных из одной монохромосомной гибридной клеточной линии.
Теоретическая основа РГ- и мейотического картирования весьма сходна. Чем ближе друг к другу на хромосоме находятся два участка, тем выше вероятность того, что оба они окажутся в одном фрагменте ДНК после облучения. Точно так же, чем ближе друг к другу находятся сайты, тем с большей вероятностью они не разойдутся при мейотическом картировании в результате рекомбинации. Основные положения, на которых базируется ΡГ-картирование, состоят в следующем: 1) индуцированный облучением разрыв между двумя сайтами не зависит от сохранения маркера; 2) сохранение фрагмента с одним маркером не зависит от сохранения любого другого фрагмента в этой же клетке.
Полученные для всех клеточных линий РГ-панели паттерны (паттерны сохранения, сигнатура) наличия (+) или отсутствия (-) каждого маркера используют для построения РГ-карты. Лод-балл рассчитывают как логарифм отношения вероятности получения конкретного паттерна сохранения двух сайтов к вероятности того, что при облучении эти сайты всегда разделяются разрывом. В отличие от мейотической рекомбинации, θ для частоты радиационных разрывов принимает значения от 0 до 1; θ = 0
462 ГЛАВА 20
означает, что два маркерных сайта никогда не разделяются при определенной дозе облучения, т. е. они тесно сцеплены. При θ = 1 маркеры всегда разделяются при определенной дозе облучения, т. е. вообще не сцеплены. Если лод-балл равен или больше +3,00, можно с уверенностью говорить о сцеплении двух маркеров. Разработаны компьютерные программы, позволяющие упорядочивать сайты и определять расстояние между ними на РГ-карте.
Расстояние между сайтами на РГ-карте измеряется в так называемых сантирэях (сР). Поскольку размер фрагментов обратно пропорционален дозе облучения, необходимо указывать дозу, при которой была получена данная РГ-панель и построена РГ-карта. Например, расстояние в 1 сР8000 означает, что при дозе 8000 рад между двумя маркерами происходит разрыв в 1% случаев.
Прямой связи между сантирэями и числом пар нуклеотидов не существует. Можно лишь сказать, что чем выше доза в радах, тем меньше физическое расстояние для конкретной величины в сантирэях. Например, расстояния в 1 сР9000, 1 сР8000, 1 сР6000 , 1 сР5000 , 1 сР3000 эквивалентны примерно 50, 53, 62, 90 и 100 т. п. н. соответственно. Мейотическое же (генетическое) картирование способно дифференцировать сайты, находящиеся на расстоянии друг от друга в лучшем случае l сМ, т. е. 1000 т. п. н. РГ-карты не только имеют более высокое разрешение, но и являются более полными, чем генетические. Кроме того, РГ-картирование проще мейотического в техническом плане, а новые сайты можно быстро включать в ранее построенную РГ-карту. К сожалению, РГ-картирование не позволяет локализовать гены тех или иных заболеваний в специфических районах хромосомы. Несмотря на это при построении мультилокусных карт хромосом человека РГ-картирование, вероятно, вытеснит картирование по сцеплению, основанное на генотипировании членов СЕРН-семей.
Физическое картирование генома человека
Генетические и РГ-карты указывают линейное расположение маркерных сайтов. Расстояния между сайтами измеряются в условных едини-
цах, которые отражают частоту рекомбинации (сМ) или вероятность сохранения двух сайтов в одном радиационном гибриде (сР). Эти единицы можно перевести (в некотором приближении) в единицы реальных физических расстояний — пары нуклеотидов, которые используются в физических картах. Физическая карта целой хромосомы или ее области дает непосредственное представление о расположении генов в ДНК, что облегчает их идентификацию и характеристику и систематическое секвенирование хромосомной ДНК.
Дата добавления: 2015-07-14; просмотров: 669;
