E. M. Donaldson, P.Swanson, W.-K. Chan. 1 страница
1994. Extraordinary salmon growth. Nature 371: 209-210.
Diamond L. E., K. R. McCurry, M. J.Martin, S. B. McClellan, E. R. Oldham, J. L. Platt, J.S. Logan. 1996. Characterization of transgenic pigs expressing functionally active human CD59 on cardiac endothelium. Transplantation 61: 1241-1249.
DiTuffio P., S. H. Cheng, J. Marshall, R. J. Gregory, K. Ebert, H. M. Meade, A. E. Smith.1992. Production of cystic fibrosis transmembrane conductance regulator in the milk of transgenic mice. Bio/Technology 10: 74-77.
Fishwild D. M.,S. L.O'Doimcll, T. Bengoechea, D. V. Hudson, F.Harding, S. L·. Bernhard, D. Jones, R.M. Kay, K.M. Higgins,S. R.Schramm, N. Lunbcrg. 1996. Iligh-avidity human IgGK monoclonal antibodies from a novel strain of minilocus transgenic mice. Nat. Biotechnol. 14: 845—851.
Fodor W. L., B. L. Williams, L. A.Malis, Л. A. Madri, S. A. Rollins, J. W. Knight, W.Velander, S. P. Squinto.1994. Expression of a functional human complement inhibitor in a transgenic pig as a model for the prevention of xenogeneic hyper-acute organ rejection. Proc. Natl Acad. Sei. USA 91:11153-11157.
Games D., D. Adams, R. B. Alessandrini, R. Barbour, P. Berthelette, C. Blackwell, T. Carr, J. Clemens,T. Donaldson, F. Gillespic, T. Guido, S. HaKopian, K. Johnson-Wood, K. Khan, M. Lee, P. Leibowit/, I. Lieberburg, S. Little, £. Masliah,L. McConlogue, M. Montoya-Zavala, L. Muckc, L. Paganini, E. Pcnniinan, M. Power, D. Schenk, P. Seubert, B. Snyder, E. Soriana, H. Tan, J.Vitale, S. Wadsworth, B. Wotarin, J. Zhao.
1995. Alzheimer-type neuropathology in transgenic mice overexpressing V717F ß-amyloid precursor protein. Nature 373: 523—527.
Gong /., C. T,.. Hew. 1995. Transgenic fish in aqua-culture and developmental biology. Curr. Top. Dev. Biol. 30: 177-214.
Hsiao K., P. Chapman, S. Nilsen, C. Eckman, Y.Harigaya, S. Younkin, F.Yang, G. Cole.1996.
Correlative memory deficits, Aß elevation, and amyloid plaques in transgenic mice. Science 274: 99-102.
Humphries M. M,, D. Rancourt, G. J. Farrar, P. Kenna, M. Hazel, R.A. Bush, P. A. Sieving,
D. M. Shells,N. McNally, P. Creighton, A. Erven, A. bofos, K. Gulya, M. R. Capecchi, P.Humphries. 1997. Retinopathy induced in mice by targeted disruption of the rhodopsin gene. Nat. Genet. 15: 216-219.
Janne J., J.-H.Hyttinen, T. Peura, M. Tolvanen, L. Alhonen, R.Sinervirta, M. Halmekyto. 1994. Transgenic bioreactors. Int. J. Biochem. 26:859-870.
Johnson-Wood K., M. Lee, R. Motter, K. Hu, G. Gordon, R. Barbour, K. Khan, M. Gordon, H. Tan, D. Games, I.TJebcrburg, D. Schenk, P. Seubert, L. McConlogue.1997. Amyloid precursor protein processing and Aß42 deposition in ά transgenic mouse model of Alzheimer disease. Proc. Natl. Acad. Sei. USA 94: 1550-1555.
Krimpenfort P.,A. Rademakers, W. Eyestone,A. van der Schans, S. van den Brock, P. Kooiman,
E. Kootwijk, G. Platcnburg, F. Pieper, R. Strykcr, H. de Boer.1991. Generation of transgenic dairy cattle using "in vitro" embryo production. Bio/Technology 9: 844—847.
Masliah E., A.Sisk, M. Mallory, L. Mucke,D. Schenk, D. Games.1996. Comparison of neu-rodegenerative pathology in transgenic mice overexpressing V7I7F ß-amyloid precursor protein and Alzheimer's discease. J. Neurasci. 16: 5795-5811.
McCurry K. R., D. L. Kooyman, C. G.Atvarado, A. H. Cotterell, M. J.Martin, J. S. Logan, J. L. Platt. 1995. Human complement regulatory proteins protect swineto-primate cardiac xenografts from humoral injury. Nat. Med. 1:423-427.
Mendez M. J., L. L. Green, J. R. F. Corvalan, X.-C. Jia, C. E. Maynard-Currie, X. Yang, M. L.GaUo, D.M. Louie, D. V. Lee, K. L.Erickson, J. Luna, C. M.-N. Roy, H.Abderrabim,
F. Kirschenbaum, M. Noguchi, D. M.Smith, A. Fukushiina, J. F. Hales, M. H. Finer, C. G. Davis, K. M. Zsebo, A. Jakobovits.1997, Functional transplant of megabase human immunoglobulin loci recapitulates human antibody response in mice. Natl. Genet. 15: 146-156.
Трансгенные животные 441
Oster-Granite M. L., D. L. McPhie, J. Greenan, R. L. Neve.1996. Age-dependent neuronal and synaptic degeneration of mice transgenic for the С terminus of the amyloid precursor protein. J. Neurosci. 16:6732-6741.
Petite J. N., M. E. Clark, G. Liu, A. M. Verrinder Gibbins, R. J. Etches.1990. Production of somatic and germline chimeras in the chicken by transfer of early blastodermal cells. Development 108: 185-189.
Pursel V. G., C. A. Pinkert, K. F. Milter, D. J. Bolt, R. G. Campbell, R. D. Palmiter, R. L. Brinster, R. E. Hammer.1989. Genetic engineering of livestock. Science 244: 1281-1288.
Sang H. 1994. Transgenic chickens—methods and potential applications. Trends Biotechnol. 12: 415-420.
Sharma A., M. J. Martin, J. F. Okabe, R. A. Truglio, N. K. Dhanjal, J.S. Logan, R. Kumar.1994. An isologous porcine promoter permits high level expression of human hemoglobin in transgenic swine. Bio/Technology 12: 55—59.
Sims M., N. L. First.1993. Production of calves by transfer of nuclei from cultured inner cell mass cells. Proc. Natl. Acad. Sei USA 90: 6143-6147.
Swanson M.E., M. J. Martin, K. O'Donn, K. Hoover, W.Lago, V. Huntress, С. Т. Parsons, C. A. Pinkert, S. Pilder, J. S. Logan.1992. Production of functional human hemoglobin in transgenic swine. Bio/Technology 10:557—559.
Wcidle U. H., H. Lenz, G. Вгспк1991. Genes encoding a mouse monoclonal antibody are
expressed in transgenic mice, rabbits, and pigs. GeneW: 185-191.
Wilmut L, A. E. Schnieke, J. McWhir, A. J. Kind, K. H. S. Campbell.1997. Viable offspring derived from fetal and adult mammalian cells. Nature 385:810-813.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Как получают трансгенных мышей?
2. В чем состоит принцип позитивно-негативной селекции?
3. Что из себя представляют мыши с «нокаутированным» геном? Как и для чего получают таких мышей?
4. Каковы преимущества и недостатки трансгенных мышей как модельных систем для исследования болезней человека?
5. Что такое клонирование?
6. Расскажите, как с помощью трансгеноза можно получать моноклональные антитела человека,
7. Как молочная железа может быть использована в качестве «биореактора» для синтеза коммерческих продуктов.
8. Каким образом трансгеноз может облегчить трансплантацию органов?
9. Какие подходы используются для выведения транс генных цыплят?
10. Опишите способы улучшения пород рыб с помощью трансгеноза.
ГЛАВА 20.
Молекулярная генетика человека
Состояние здоровья человека зависит от многих факторов: его образа жизни, биологии, условий окружающей среды, качества системы здравоохранения и т. д. За последние десятилетия достигнуты значительные успехи в диагностике, лечении и профилактике инфекционных болезней, поэтому более очевидным стало влияние генетических факторов, особенно в развитых странах. Например, в Канаде, согласно статистическим данным, у 5% населения в возрасте до 25 лет обнаруживаются наследственные дефекты, приводящие к инвалидности, а у более чем 50% в течение жизни развивается заболевание, имеющее в той или иной степени наследственную природу. В настоящее время более половины случаев обращения в детские лечебные учреждения связаны с генетическими заболеваниями.
Наследственными являются свыше 1000 болезней человека. Большинство из них очень редки (~10~5), но некоторые встречаются относительно часто (~10~4), Многие наследственные заболевания человека обусловливаются мутациями в единственном гене, однако ряд сложных патологий, например рак, определяется мутациями в нескольких генах. В том случае, когда имеется полное, точное и последовательное описание симптомов заболевания (фенотипа), определяемого единственным геном, генетическую природу заболевания можно установить исходя из типа его наследования в семьях, представленных несколькими поколениями. Существуют четыре основных типа наследования: аутосомно-доминантный (рис. 20.1), аутосомно-рецессивный (рис. 20.2), X-сцепленный доминантный (рис. 20.3) и Х-сцепленный рецессивный (рис, 20.4). Термин «аутосомный» относится к 22 парам неполовых хромосом (аутосом) человека, а термин «Х-сцепленный» указывает на локализацию гена на Х-хромосоме. Доминантным называют такое состояние, когда для проявления заболевания достаточно присутствия одного мутантного аллеля данного гена, а в случае рецессивного заболевания дефектными должны быть оба аллеля. У мужчин в ядре присутствует одна Х-хромосома, поэтому большинство Х-сцепленных генов независимо от того, являются они доминантными или рецессивными, приводят к проявлению заболевания.
Анализ родословных чрезвычайно полезен для установления типа наследования специфического состояния, однако не дает никакой информации об ассоциированном с данным заболеванием гене, о биологической основе нарушения или — в случае аутосомного заболевания — о хромосомной локализации гена. Более того, не всегда можно определить, является ли заболевание наследственным. Во-первых, не у всех лиц, несущих дефектный ген, проявляются симптомы заболевания (неполная пенетрантность). Во-вторых, симптомы (фенотип) могут варьировать от слабых до ярко выраженных (варьирующая экспрессивность). В-третьих, один и тот же фенотип может обусловливаться дефектами в совершенно разных генах (генетическая гетерогенность). В-четвертых, в некоторых случаях альтернативные формы (аллели) одного гена могут приводить к разным фенотипам. В-пятых, из-за небольшого размера семей со случаями исследуемого заболевания приходится собирать данные о большом числе родословных, чтобы сделать вывод о природе этого заболевания.
Успех в установлении корреляции между нормальным или патологическим фенотипом, с одной стороны, и соответствующим ему генотипом, с другой, в значительной степени зависит
Молекулярная генетика человека 443

| Рис. 20.1. Аутосомно-доминантный тип наследования. Квадратиками изображены мужчины, кружками — женщины; закрашенные символы — больные члены семьи, незакрашенные — здоровые. Горизонтальная линия, соединяющая квадратик и кружок, означает, что данные мужчина и женщина являются супругами. Вертикальные линии ведут к их потомкам, родившимся в том порядке, как они расположены на рисунке, слева направо. Римскими цифрами (I, II и III) обозначены поколения, арабскими (1, 2 и 3) — члены семьи в каждом поколении. Для точного обозначения конкретного члена семьи используется двузначный код (например, II-3). Характерными признаками аутосомно-доминантного типа наследования являются: 1) симптомы заболевания проявляются в последующих поколениях в случае полной пенетрантности (т. е. если каждый генотип проявляется фенотипически); 2) лица мужского и женского пола поражаются с одинаковой частотой. |
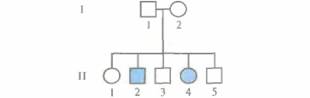
| Рис. 20.2. Аутосомно-рецессивный тип наследования. Характерные признаки: 1) у здоровых родителей могут появляться больные дети; 2) лица мужского и женского пола поражаются с одинаковой частотой; 3) если больны оба родителя, то больны и все их дети (эта ситуация на рисунке на отражена). |
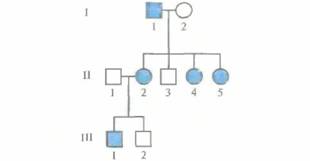
| Рис. 20.3. Х-сцепленный доминантный тип наследования. Характерные признаки: 1) в случае полной пенетрантности больные присутствуют в каждом поколении; 2) больны все дочери пораженного мужчины, а все его сыновья здоровы; 3) в последующих поколениях часто проявляется тип наследования «от отца — кдочери - к ее сыну»; 4) число больных женского пола может быть больше, чем мужского. |
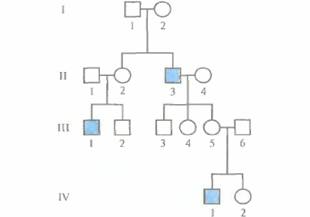
| Рис. 20.4. Х-сцепленный рецессивный тип наследования. Характерные признаки: 1 ) у здоровых родителей могут рождаться больные дети; 2) нет прямой передачи заболевания от отца ксыну; 3) больных мужского пола больше, чем женского. |
от того, удается ли идентифицировать и изолировать (клонировать) конкретный ген. Зная нуклеотидную последовательность гена, можно определить, какую функцию выполняет его продукт в норме, как нарушается эта функция в результате мутации, в какой степени различные мутации в разных экзонах ответственны за проявление заболевания. Если ген клонирован, можно поставить такие эксперименты, которые позволяли бы установить функции генного продукта, его взаимодействиесдругими веществами и характер нарушения нормальных процессов, вызываемого продуктом мутантного гена. Кроме того, основываясь на различиях в нуклеотидных последовательностях нормального и мугантного генов, можно разработать диагностические тесты для выявления специфических мутаций. Чем полнее
444 ГЛАВА 20
будут наши знания о функциях гена, ответственного за то или иное заболевание, тем более эффективную схему лечения мы сможем предложить.
Клонирование генов человека не всегда состоит из строго определенных последовательных процедур. Скорее существует набор различных инструментов и способов, используемых в зависимости от конкретных условий. Например, начальный этап поиска гена, ответственного за данное заболевание, определяется наличием информации о его продукте. Как правило, при идентификации генов, ассоциированных с различными заболеваниями, нельзя обойтись без генетических и физических карт, а построение таких карт в конечном счете поможет определить нуклеотидную последовательность всего генома человека. Генетическая карта (карта сцепления) показывает расположение определенных сайтов (локусов) вдоль хромосомы. Для построения полных карт сцепления необходимо, чтобы локусы каждой хромосомы были представлены часто встречающимися аллелями и чтобы можно было легко идентифицировать каждый из них. Физическая карта — это набор упорядоченных клонов ДНК, охватывающих всю хромосому или какую-то ее область. На практике эти клоны перекрываются, образуя последовательность фрагментов, называемую контигом. Длина участка, охватываемого контигом, выражается в парах нуклеотидов. Физическая карта, состоящая из контигов, служит основой при построении окончательной физической карты, которая представляет собой полную нуклеотидную последовательность хромосомы.1)
1) Полная нуклеотидная последовательность каждой из хромосом человека уже определена. Более того, идентифицирована значительная часть генов, определена их структура. (Т.С. Venter et al., ,Science, 16 Feb. 2001. v. 291, N 5507,p. 1303; E. Lander. Nature, 2001, v, 409, No 6822, p. 860). - Прим. ред.
Генетическое сцепление и картирование генов
В 1865 г. Грегор Мендель, основываясь на результатах своих опытов с садовым горохом, сформулировал основные принципы наследования признаков. Во-первых, он пришел к выводу, что единицы наследственности дискретны, встречаются парами и могут существовать в альтернативных формах. Позже (1905 г.) эти единицы назвали генами, а варианты одного гена -аллелями.
Во-вторых, Мендель обнаружил, что в половую клетку (гамету) попадает только один ген из каждой пары. В-третьих, он заключил, что пары генов образуются независимо друг от друга, поэтому результатом единственного генетически значимого скрещивания будут все возможные генетические комбинации — в том случае, если число потомков достаточно велико (рис. 20.5). Последнее заключение, хотя Мендель и не знал этого, справедливо только для пар генов, находящихся на разных хромосомах или по крайней мере на разных концах одной хромосомы. В экспериментах Менделя ни при одном
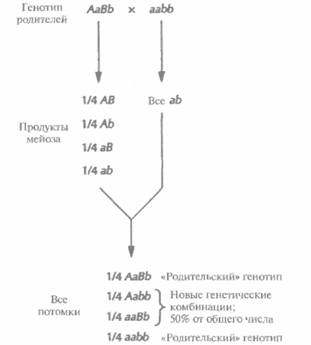
| Рис. 20.5. Независимое распределение генов. При скрещивании дигетерозиготного индивида (АаВb) с индивидом, гомозиготным по двум рецессивным признакам (aabb), 50% потомков будут иметь родительские генотипы (АаВb, aabb), a 50% — новые комбинации генотипов (Aabb, ааВb) — в том случае, если число потомков достаточно велико для получения репрезентативной выборки. Этот результат означает, что гены А и В распределяются независимо, у потомков встречаются все возможные комбинации гамет каждого из родителей. Необходимо заметить, что процентное соотношение «родительских» и комбинированных типов зависит от генотипов родителей; например, в результате скрещивания особей с генотипами ААВВ и aabb потомки в 100% случаев будут иметь генотип, отличный от родительских (АаВb). |
Молекулярная генетика человека 445
из скрещиваний не затрагивались такие пары генов, которые находились на одной хромосоме близко друг от друга. В противном случае он заметил бы, что эти гены наследуются не независимо, как сейчас говорят, они сцеплены.
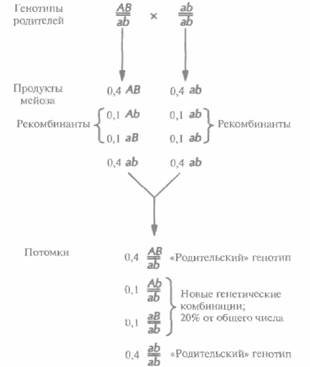
В принципе при полном генетическом сцеплении все гены любой хромосомы должны передаваться в половые клетки в виде неразделимых блоков, не образуя в процессе мейоза новых генетических комбинаций на хромосомах (рис. 20.6). Однако в большинстве случаев сцепление является неполным. При мейозе происходит обмен (рекомбинация, кроссовер) между генными сайтами (локусами), и создаются новые комбинации генов (рис. 20.7). Поскольку обычно рекомбинация происходит тем чаще, чем больше расстояние между двумя специфическими генными локусами, частоту рекомбинаций можно использовать как меру расстояния (генетического расстояния) между двумя генами. Таким образом, анализируя частоты рекомбинаций у потомков родителей, гетерозиготных по ряду сцепленных генов, можно построить генетическую карту, на которой гены будут расположены в линейном порядке. Расстояние между локусами отражает лишь частоту рекомбинаций и не эквивалентно точному физическому расстоянию. Однако, сравнивая физические и генетические карты хромосом, удалось установить соответствие между частотой рекомбинаций и

| 
|
| Рис. 20.6. Полное сцепление. Рассматриваемые аллели д и гетерозиготного родителя, АВ//ab, находятся в фазе сцепления (цис), второй родитель гомозиготен по двум рецессивным признакам, его генотип ab//ab. В отсутствие рекомбинации между локусами А и В все потомки будут иметь родительские генотипы, половина — генотип AB//ab и половина — ab//ab. Полное сцепление не всегда означает отсутствие новых генетических комбинаций: например, все потомки от скрещивания Ab//aB x AB//ab будут иметь новые генетические комбинации, а именно: Ab//AB, Аb//аb, аВ//АВ и aB//ab. Однако в отсутствие рекомбинации гены одной и той же хромосомы будут всегда сцеплены вместе. Для удобства генетическая номенклатура использует одну горизонтальную или косую черту вместо двух для обозначения сцепления локусов пары одинаковых (гомологичных) хромосом. | Рис. 20.7. Неполное сцепление. В данном примере 20% (т. е. 0,1 + 0,1 = 0,2) потомков имеют генотипы, сформировавшиеся в результате рекомбинации(й) между локусами А и В в процессе мейоза. Частота рекомбинаций не зависит от генотипов родителей. Родитель, гомозиготный по двум рецессивным признакам, производит только олин тип гамет даже в случае рекомбинации. В анализирующем скрещивании ре-комбинантные продукты мейоза проявляются у потомков фенотипически. |
446 ГЛАВА 20
числом нуклеотидных пар ДНК. В качестве единицы при картировании используется 1 сантиморганида (сМ), величина, равная частоте рекомбинаций 1%, что для человека соответствует примерно 106 пар нуклеотидов (п. н.).
Отметим несколько важных моментов, касающихся генетического сцепления и картирования генов. Во-первых, чтобы можно было оценить частоту новых генетических комбинаций (рекомбинантов), один из родителей должен быть гетерозиготен как минимум по двум локусам (AB/ab или Аb/аВ). Во-вторых, дигетерозиготные генотипы должны существовать в двух конфигурациях (фазах). Если два сцепленных гена на каждой из хромосом представлены одним типом аллелей (т. е. оба доминантные, AB, или оба рецессивные, ab), то такую конфигурацию называют фазой сцепления (цис-фазой). Если же два сцепленных гена на каждой хромосоме представлены разными типами аллелей (т. е. один доминантный, а другой рецессивный, аВ или Ab), то конфигурацию называют фазой отталкивания (транс-фазой). В-третьих, рекомбинация между двумя генами происходит независимо от их фазы. С точки зрения генетики рекомбинация между генами, находящимися в дигомозиготном состоянии (т. е. Ab/Ab или AB/AB), не приводит к появлению новой генетической комбинации, и поэтому, даже если подобная рекомбинация происходит, ее невозможно обнаружить. В-четвертых, частота рекомбинации 0% означает полное сцепление, а 50% — что гены расположены либо на разных хромосомах, либо на одной хромосоме, но удалены друг от друга слишком далеко для выявления сцепления. Для решения проблемы картирования двух сильно удаленных генов, расположенных на одной хромосоме, необходимо картировать гены, лежащие между ними, что позволит определить, образуют ли все они одну группу сцепления.
Для построения подробных генетических карт некоторых эукариотических организмов, таких как мышь, кукуруза, плодовая мушка, нематоды и дрожжи, необходимо идентифицировать целый ряд генов, каждый из которых представлен по крайней мере двумя аллелями. Затем нужно провести скрещивания и подсчитать частоту рекомбинаций у большого числа потомков. Результаты отражают степень сцепления между генами. В конце концов, используя мультифакторные (более двух пар сцепленных генов) скрещивания, можно получить детальные генетические карты.
Обнаружение и оценка генетического сцепления учеловека
До появления в начале 1980-х гг. технологии рекомбинантных ДНК обнаружение и оценка генетического сцепления у человека представляли собой сложную и очень трудоемкую процедуру, которая к тому же обычно оказывалась безуспешной. При этом исследователи сталкивались с целым рядом проблем. Во-первых, генетический статус родителей обычно бывает неизвестен, что затрудняет разграничение рекомбинантных и нерекомбинантных потомков. Во-вторых, немногочисленность большинства семей снижает статистическую достоверность полученных результатов.
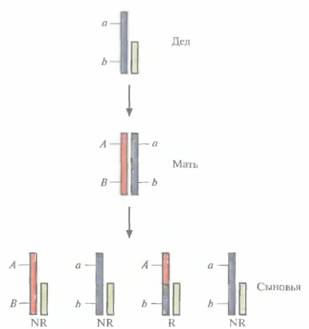
Наличие у мужчин одной Х-хромосомы значительно облегчает оценку генетических расстояний между генными локусами. В данном случае все аллели генов, расположенных на Х-хромосоме, проявляются фенотипически. Сыновья женщин, дигетерозиготных по Х-сцепленным локусам, получают рекомбинантную или нерекомбинантную Х-хромосому. Если фаза, в которой аллели двух генных локусов находятся у матерей, известна, то среди сыновей легко установить рекомбинантные и нерекомбинантные типы. Генотипы отцов в данном случае не имеют значения, поскольку сыновья наследуют только материнскую Х-хромосому. Иногда фазу аллелей у дигетерозиготной матери можно установить исходя из фенотипа ее отца. Например, если у отца матери (деда) два Х-сцепленных признака рецессивны, а у нее самой — доминантны, то мать дигетерозиготна, а рассматриваемые аллели находятся в цис-фазе, т. е. AB/ab (рис. 20.8), Этот метод обнаружения сцепления основан на подсчете двухлокусных фенотипов у сыновей большого числа дигетерозиготных женщин с известной фазой аллелей. В этом случае доля хромосом, рекомбинантных по двум специфическим генным локусам (рекомбина-ционный индекс), будет равна сумме рекомбинантных хромосом (А), деленной на общее чис-
Молекулярная генетика человека 447
|
| Рис. 20.8. Картирование Х-хромосомы. В этом случае генетическая фаза двух или большего числа Х-сцепленных локусов у дочери (Мать) устанавливается на основании данных о Х-сцепленных аллелях ее отца (Дед). Эту информацию в свою очередь используют для определения, какие из ее сыновей (Сыновья) получили рекомбинантную (R) и нерекомбинантную (NR) хромосому. В данном примере дед несет два рецессивных гена в локусах А и В Х-хромосомы, его дочь дигетерозиготна, а рассматриваемые аллели находятся у нее в цис-фазе. На Х-хромосоме показаны аллели локусов А и В, Υ-хромосома изображена в виде более короткой полоски. |
ло хромосом — рекомбинантных и нерекомби-нантных (NR):
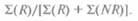
Однако данный подход имеет ряд недостатков. Во-первых, не всегда можно определить генотип деда, а следовательно, фаза, в которой находятся аллели у предположительно дигетерозиготной матери, остается неизвестной. Во-вторых, не все матери в большой выборке семей будут гетерозиготны по одним и тем же двум локусам. Несмотря на все усилия, до 1980-х гг. не удавалось построить достаточно протяженную однозначную карту сцепления Х-хромосомы человека, основанную на подсчете рекомбинантных и нерекомбинант-ных хромосом. В то время было известно всего несколько локусов и слишком мало аллелей было идентифицировано.
Анализ сцепления методом максимального правдоподобия: логарифм соотношения шансов (лод-балл)
Кроме метода, в котором определяется частота рекомбинаций между двумя локусами на основании прямого подсчета рекомбинантных и нерекомбинантных хромосом, необходимо было разработать более общий, непрямой метод, который: 1) мог бы строго различать независимое распределение и сцепление; 2) не обязательно опирался бы на данные о фазе аллелей дигетерозиготных родителей; 3) мог суммировать информацию, полученную от большого количества различных семей; 4) позволял оценить рекомбинационный индекс в том случае, когда сцепление обнаружено. Такой метод, широко использующийся в настоящее время, был создан в 1955 г. Мортоном.
При изучении сцепления рекомбинационный индекс обозначается греческой буквой тега (θ), В методе Мортона сравнивается вероятность L,(θ) того, что у братьев и сестер (сибсов) два локуса сцеплены (т. е. локализованы на одной хромосоме и находятся близко друг от друга), с вероятностью L(0.50) того, что два локуса не сцеплены (т. е. находятся на разных хромосомах или далеко друг от друга в пределах одной хромосомы), для любого рекомбинационного индекса θ. В случае сцепления, поскольку рекомбинационный индекс неизвестен, он может принимать любое значение в интервале от 0 до 0,5 (0 < θ < 0,50). Если же два локуса распределяются независимо, то θ = 0,50 по определению. Другими словами, в том случае, когда половина гамет, полученных от дигетерозиготного родителя, содержит новые генетические комбинации, два локуса находятся либо на негомологичных хромосомах, либо настолько далеко друг от друга на одной хромосоме, что это выглядит так, будто они расположены на разных хромосомах. Следовательно, если L(θ) = L(0,50), то два локуса не сцеплены. Десятичный логарифм отношения этих двух вероятностей, т.е. log[L,(θ)/L(0,50)], представляет собой логарифм соотношения шансов (log-of-odds ratio), называемый лод-баллом (LOD). Лодд-балл обозначают буквой Ζ; Ζ(θ ) — это лод-балл для данного значения θ, где 0 < θ < 0,50.
448 ГЛАВА 20
L(θ ) можно определить, если известна вероятность получения конкретного сочетания рекомбинантных и нерекомбинантных хромосом для сибсов каждой изучаемой семьи. Вероятность того, что потомки получат от дигетерозиготного родителя нерекомбинантную хромосому, равна 1/2(1-θ) + 1/2(1-θ), или 1— θ, а вероятность того, что они получат рекомбинантную хромосому, -1/2θ + 1/2θ, или θ. Например, в семье с пятью детьми вероятность для каждого из них получить нерекомбинантную хромосому от дигетерозиготного родителя составляет K(1—θ)5, где (1—θ) -вероятность получения нерекомбинантной хромосомы, показатель степени 5 — число сибсов с нерекомбинантной хромосомой, точнее, число нерекомбинантных хромосом у сибсов, К — коэффициент. Если все хромосомы одинаковы, т. е. все нерекомбинантные или все рекомбинантные, то К = 1 (т. е. 5!/5!0!, или n!/n!0!, где n — число сибсов в данной семье), В семье с четырьмя детьми вероятность того, что все они получат рекомбинантную хромосому от дигетерозиготного родителя, составляет θ4. Далее, вероятность того, что в семье с девятью детьми пять получат нерекомбинантные хромосомы и четыре — рекомбинантные, равна К(1-θ)5(θ)4, где К= 126, т, е. 9!/5!4!. Лод-балл выражается как отношение величин, имеющих одинаковые коэффициенты. Эти коэффициенты, стоящие в числителе и знаменателе, сокращаются, а потому при анализе сцепления не учитываются.
Дата добавления: 2015-07-14; просмотров: 689;
