ГЛАВА 18
Чтобы получить растения, устойчивые к вирусам, проводили их «иммунизацию» вирусными генами, кодирующими белки оболочки, другими вирусными генами или антисмысловыми последовательностями вирусного генома.
Если в трансгенном растении экспрессирует-ся ген, кодирующий белок оболочки вируса, который обычно инфицирует это растение (а данный белок зачастую является основным белковым компонентом вируса), то способность вируса проникать в растение и распространяться в нем часто значительно уменьшается. Механизм ингибирования пролиферации вируса в присутствии генов белка оболочки точно не установлен, однако ясно, что противовирусное действие начинает проявляться на ранних стадиях репликации вируса, так что вирусные частицы не образуются. Это снижает вероятность возникновения спонтанных вирусных мутантов, способных к репликации в присутствии вирусного белка оболочки. С помощью этого подхода были получены устойчивые к различным вирусам трансгенные растения множества различных зерновых культур (табл. 18.3). И хотя абсолютной устойчивости при этом достичь не удавалось, ее уровень был весьма высок. Более того, обнаружилось, что ген белка оболочки одного вируса иногда обеспечивает устойчивость к широкому кругу неродственных вирусов. Ценность подхода повышается и благодаря тому, что грансгенные растения развиваются одинаково как в полевых условиях, так и в лаборатории.
Молекула РНК, комплементарная транскрипту нормального гена (мРНК), называется антисмысловой, а сама мРНК, участвующая в трансляции, — смысловой. Антисмысловая РНК образует дуплекс с мРНК, блокируя тем самым трансляцию, так что в ее присутствии синтез белкового продукта соответствующего гена уменьшается. Кроме того, дуплекс антисмысловая РНК—мРНК быстро деградирует, что уменьшает содержание конкретной мРНК в клетке. Учитывая все сказанное выше, можно попытаться предотвратить репликацию растительных вирусов и защитить от них растения, введя в них ген, обеспечивающий синтез антисмысловых РНК, комплементарных мРНК вирусного белка оболочки.
| Таблица 18.3. Некоторые устойчивые к вирусам трансгенные растения, синтезирующие белки оболочки вирусов1) | |
| Растение | Вирусы — источники генов |
| Nicoiiana benthamiana, N. clevelandii | Вирус скрытой мозаики сливы |
| N. benthamiana, тыква | Вирус 2 мозаики арбуза |
| N. benthamiana, тыква | Вирус желтой мозаики кабачков |
| Папайя, табак | Вирус кольцевой пятнистости папайи |
| Картофель | Вирус скручивания листьев картофеля |
| Картофель | Вирус V картофеля |
| Картофель, Nicotiana debneyii | Вирус S картофеля |
| Картофель, табак | Вирус X картофеля |
| Рис | Вирус полосатости риса |
| Табак | Вирус мозаики резухи |
| Табак | Вирус мозаики сои |
| Табак | Вирус гравировки табака |
| Табак | Вирус полосатости табака |
| Табак | Вирус бронзовости томата |
| Табак, люцерна, томат | Вирус мозаики люцерны |
| Табак, огурец | Вирус мозаики огурца |
| Табак, N. benthamiana | Вирус погремковости табака |
| Табак, томат | Вирус табачной мозаики |
| Томат | Вирус мозаики томатов |
| 1) По данным работы Fitchen, Beachy, Annu. Rev. Mtcrobiol. 47: 739-763. 1993. |
Для сравнения эффективности подходов, основанных на использовании вирусного гена белка оболочки, с одной стороны, и антисмысловой РНК - с другой, клонировали кДНК белка оболочки вируса мозаики огурца (CuMV) в растениях табака в двух ориентациях, «смысловой» и «антисмысловой» (в каждом конкретном растении — одна из этих ориентации), а затем определили чувствительность трансгенных растений к вирусной инфекции (рис. 18.6). Геном CuMV представлен тремя отдельными одноцепочечными молекулами РНК, каждая из которых кодирует определенный вирусный белок. In vivo одна из этих молекул — РНК3 — подвергается процессингу; часть ее последовательности удаляется и образуется РНК4, кодирующая вирусный белок оболочки. Создание трансгенных растений, которые синтезируют либо нормальную мРНК и вирусный белок оболочки, либо соответствующую антисмысловую РНК, включает следующие
Геннаяинженерия растений; применение 397
| Рис. 18.6. Процедура введения кДНК белка оболочки вируса мозаики огурца в растительные клетки. РНК4, кодирующую белок оболочки, выделяют из суммарного препарата вирусной РНК и используют в качестве матрицы для синтеза двухцепочечной кДНК. К кДНК присоединяют линкерные последовательности и встраивают ее в вектор на основе Е. coli-плазмиды. Отбирают клоны, содержащие полноразмерную кДНК, вырезают ее из Е. coli-вектора и встраивают в Ti-плазмидный вектор между 35S- промотором вируса мозаики цветной капусты (p35S) и сигналом терминации транскрипции гена малой субъединицы рибулозобисфосфат-карбоксилазы (tRBC). При этом кДНК РНК4 встраивается в двух ориентациях, так что в одном случае транскриптом является смысловая РНК и синтезируется белок оболочки, в другом образуется РНК, комплементарная мРНК белка оболочки, — антисмысловая РНК. | 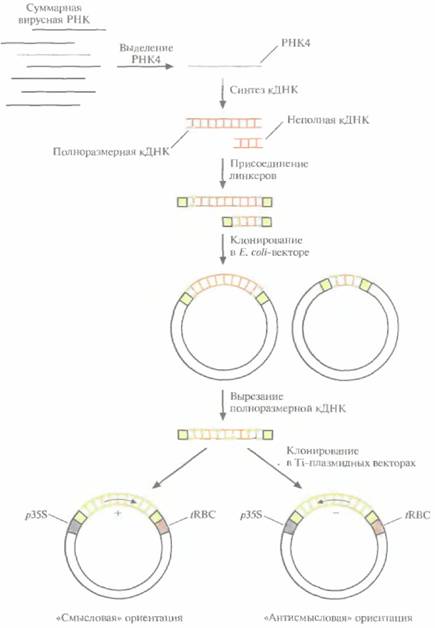
|
1. Выделение РНК4.
2. Ферментативный синтез in vitro кДНК на РНК4.
3. Присоединение к кДНК линкерных последовательностей.
4. Встраивание полноразмерной кДHК в векторы для клонирования в обеих ориентациях, в каждой из которых она находится под контролем 35S-промотора вируса мозаики цветной капусты и регуляторных сигналов терминации транскрипции растительного гена малой субъединицы рибулозобисфосфаткарбоксилазы. 5. Регенерация отдельных трансгенных растений, в геном которых встроена кДНК в одной из двух возможных ориентации.
Для введения кДНК, кодирующих смысловую (белок-кодирующую) и антисмысловую
398 ГЛАВА 18
|
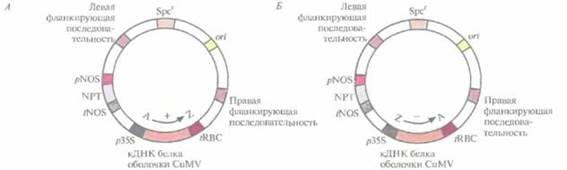
| Рис. 18.7. Бинарные клонирующие векторы на основе Ti-плазмид, содержащие кДНК белка оболочки вируса мозаики огурца (CuMV) в «смысловой» (А) или «антисмысловот (Б) ориентации. кДНК находятся под контролем 35S-промотора (p35S) вируса мозаики цветной капусты и сигнала терминации транскрипции/полиаденилирования гена малой субъединицы рибулозобисфосфат-карбоксилазы (tRBC). Векторы содержат также ген неомицинфосфотрансферазы (ген NPT), находящийся под контролем элементов регуляции транскрипции гена нопалинсинтазы (pNOS и tNOS), ген устойчивости к спектиномицину (Spcr), правую и левую фланкирующие последовательности Т- ДНК н сайт инициации репликации ДНК для широкого круга хозяев (ori). А —> Z — «смысловая» ориентация кДНК, Z —> А — «антисмысловая». |
РНК, в отдельные клетки табака использовали бинарную векторную систему на основе Ti-плазмид (рис. 18.7). ß трансгенных растениях, синтезирующих белок оболочки вируса CuMV, вирусные частицы не накапливались и симптомы инфекции не проявлялись независимо от титра инокулята. В отличие от этого трансгенные растения, синтезирующие антисмысловую РНК белка оболочки CuMV, проявляли устойчивость только при малых концентрациях вирусных частиц в инокуляте.
Сходные результаты были получены в других лабораториях, где были созданы трансгенные растения, синтезирующие антисмысловые РНК-копии генов вирусных белков оболочки, и проверено, смогут ли эти растения противостоять вирусной инфекции. Во всех случаях растения проявляли устойчивость к инфекции, только если титр используемого инокулята был мал, Общий вывод, который можно сделать из подобных экспериментов, состоит в следующем: антисмысловые РНК-копии генов вирусных белков оболочки обеспечивают гораздо худшую защиту трансгенных растений от вирусных инфекций, чем смысловые копии генов белков оболочки вируса. Возможно, не стоит совсем отказываться от стратегии защиты, основанной на использовании антисмысловой РНК, однако прежде чем внедрять эту методику, ее необходимо значительно усовершенствовать.
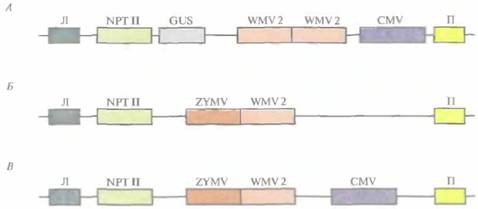
Часто сельскохозяйственные культуры бывают подвержены нескольким вирусным инфекциям; любая из них может нанести ущерб растениям и снизить урожай. В идеале трансгенные растения должны быть устойчивы более чем к одному вирусу. Чтобы достичь этой цели, для трансформации растений желтой яйцевидной тыквы (Cucurbita pepo) использовали бинарные векторы на основе Ti-плазмид, несущие один или несколько генов белков оболочки CuMV, вируса желтой мозаики кабачков и вируса 2 мозаики арбуза (рис. 18.8). Трансгенные растения, в которых экспрессировались все три гена, в лабораторных условиях были устойчивы ко всем указанным вирусам. Растения, экспрессирую-щие гены белков оболочки вируса желтой мозаики кабачков и вируса 2 мозаики арбуза, были проверены в полевых условиях на устойчивость к тлям — насекомым, являющимся природным переносчиком этих вирусов в растущие растения. Если в растении экспрессировались оба гена белков оболочки, то они проявляли полную устойчивость к одновременной инфекции этими вирусами (рис, 18.9), а если наблюдалась экспрессия только одного из вирусных белков оболочки, то заражение происходило не сразу,
Генная инженерия растений: применение 399
|
| Рис. 18.8. А. Т-ДНК, несущая ген неомицинфосфотрансферазы (NPTII) в качестве селективного маркера, ген ß-глюкуронидазы (GUS) в качестве репортерного гена, две копии гена белка оболочки вируса 2 мозаики арбуза (WMV2) и ген белка оболочки вируса мозаики огурца (CMV). Левая и правая фланкирующие последовательности Т-ДНК обозначены Л и Π соответственно. Б. Конструкция, аналогичная конструкции А , но без CMV и ΝΡΤII, содержащая одну копию WMV2 и ген белка оболочки вируса желтой мозаики кабачков (ZYMV). В. Конструкция, аналогичная конструкции Б, но содержащая CMV. Во всех трех конструкциях присутствуют соответствующие промоторы и сигналы терминации транскрипции. |
| Рис. 18.9. Частота заболеваний трансгенных растений желтой яйцевидной тыквы и растений дикого типа в полевых условиях. Для передачи растениям тыквы смеси вируса желтой мозаики кабачков (ZYMV) и вируса 2 мозаики арбуза (WMV) использовали тлю. (По данным работы Fuchs, Gonsalves, Bio/Technology 13: 1466-1473, 1995.) | 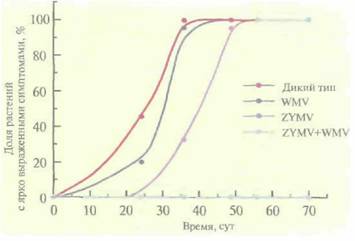
|
но в конце концов все симптомы вирусной инфекции проявлялись, и растение утрачивало коммерческую ценность. Итак, ясно, что наиболее эффективной стратегией при выведении трансгенных растений, устойчивых ко всем основным вирусам, замедляющим их рост и развитие, является введение в них нескольких генов, детерминирующих синтез белков оболочки вирусов.
Имеются предварительные данные о том, что трансгенные растения, в которых экспрессируются вирусные гены, отличные от генов белков оболочки (например, ген вирусных сателлитных РНК или ген репликации вируса), также оказываются в какой-то мере защищенными от вирусных инфекций, но насколько эффективными и применимыми будут соответствующие подходы, пока неясно.
Защита растений от патогенных вирусов может осуществляться не только их «иммунизацией» генами вирусных белков, но и при участии противовирусных белков, синтезируемых сами-
400 ГЛАВА 18
ми растениями. Например, в клеточной стенке фитолакки американской (Phytolacca americana) присутствуют три разных противовирусных белка: РАР, синтезируемый в листьях весной, РАРП, обнаруживаемый в листьях летом, и PAP-S, содержащийся в семенах. Эти белки легко выделить из водных экстрактов измельченных тканей растения. Если небольшое количество РАР нанести на листья других растений, то последние также окажутся устойчивыми к нескольким вирусам. Таким образом, ген белка РАР вполне можно использовать для получения трансгенных растений, устойчивых к широкому спектру вирусов растений.
Выделенную кДНК РАР вводили в геном табака и картофеля с помощью бинарных векторов на основе Ti-плазмид. Трансформанты, синтезирующие РАР в большом количестве (> 10 нг на l мг суммарного белка), были чахлыми, пятнистыми и бесплодными, растения же с более низким содержанием РАР (1—5 нг на 1 мг белка) имели нормальный внешний вид и были фертильны. Эти данные говорят о том, что если концентрация РАР превышает некоторый пороговый уровень, то нормальное функционирование клетки нарушается. Противовирусный эффект белка РАР в трансгенных растениях проявляется в основном в уменьшении числа повреждений; однако, если уж повреждение возникало, то растение систематически инфицировалось. Отсюда следует, что РАР подавляет вирусную инфекцию на ранней стадии. Тем не менее, когда трансгенные растения табака и картофеля, экспрессирующие РАР в небольших количествах, инфицировали вирусами картофеля X или Y, на листьях обнаруживалось значительно меньше повреждений, чем в случае нетрансформированных контрольных растений. Поскольку противовирусное действие РАР проявляется при относительно небольших его концентрациях, можно попытаться создать транс-генные растения, синтезирующие этот белок в малом количестве, и параллельно использовать другие способы защиты растений от вирусов.
Растения, устойчивые к гербицидам
Несмотря на то что на производство более 100 различных химических гербицидов во всем мире ежегодно расходуется 10 млрд. долларов, примерно 10% урожая теряется из-за большого количества сорняков. Кроме того, многие гербициды оказывают одинаковое действие на сорняки и сельскохозяйственные культуры; нередко обработку полей необходимо проводить еще до появления сорняков, а некоторые гербициды накапливаются в окружающей среде. Чтобы решить хотя бы некоторые из этих задач, можно попытаться создать сельскохозяйственные культуры, устойчивые к гербицидам. Для этого можно
• уменьшить поглощение гербицида растением
• обеспечить синтез белка, чувствительного к гербициду, в таком количестве, чтобы его хватало на выполнение присущих ему функций в присутствии гербицида
• уменьшить способность белка, чувствительного к гербициду, к связыванию с ним
• обеспечить инактивацию гербицида в растении в ходе метаболизма.
Из этих подходов были реализованы три последних. Выведенные с их помощью гербицидустойчивые трансгенные растения перечислены в табл. 18.4.
Были получены растения, устойчивые к гли-фосфату - гербициду, быстро разлагающемуся в почве на нетоксичные составляющие и потому безопасному для окружающей среды. Глифос-фат является ингибитором 5-енолпирувилши-кимат-3-фосфатсинтазы (EPSPS) - фермента, играющего важную роль в синтезе ароматических аминокислот и у бактерий, и у растений. Из глифосфатустойчивого штамма E. coli был выделен ген, кодирующий EPSPS, помещен под контроль растительного промотора и сигналов терминации транскрипции/полиаденилирования и введен в растительные клетки. Трансгенные растения табака, петуньи, томата, картофеля и хлопка, синтезировавшие EPSPS в количестве, достаточном для замены ингибированного гербицидом растительного фермента, были устойчивы к глифосфату и при обработке, в отличие от сорняков, не погибали.
Другой способ приобретения устойчивости — с помощью инактивации гербицида — был реализован для бромоксинила (3,5-дибром-4-гид-
Генная инженерия растений: применение 401
| Таблица 18.4, Некоторые примеры генетически обусловленной устойчивости к гербицидам | |
| Гербицид | Способ приобретения устойчивости |
| Триазины | Изменение гена рsbА. кодирующею хлоропластный белок D-1, на который этот гербицид действует |
| Сульфонилуреазы | Введение в растительный геном генов, кодирующих устойчивые формы ацетолактатсинтетазы (гены вводились в растения тополя, канолы, льна и риса) |
| Имидазолиноны | Отбор в культуре клеток линий, синтезирующих устойчивые формы ацетолактатсинтетазы |
| Арилоксифеноксипропионаты циклогександионы | Эти гербициды ингибируют ацетил-СоА— карбоксилазу. Отбор проводился в культуре тканей. Устойчивость обеспечивалась либо изменением фермента, так что он становился нечувствительным к гербициду, либо разрушением гербицида |
| Глифосфат | Устойчивость обеспечивается сверхпродукцией фермента EPSPS, на который действует этот гербицид. Устойчивость приобретается трансформацией сои геном EPSPS, устойчивой к глифосфату, и табака геном глифосфатоксидоредуктазы, которая разрушает глифосфат |
| Бромоксинил | Устойчивость к этому ингибитору фотосистемы II обеспечивается трансформацией табака или хлопка бактериальным геном нитрилазы, кодирующим фермент, разрушающий гербицид |
| Феноксикарбоксильные кислоты (например, 2,4-D и 2,4.5-Т) | Устойчивые растения табака и хлопка были созданы трансформацией геном tfdA из Alcaligenes, кодирующим диоксигеназу, которая разрушает гербицид |
| Глюфолинат (фосфинотрицин) | Более 20 различных растений были трансформированы либо геном bar из Streptomyces hygroscopicus, либо геном pat из S. viridochromogenes. Фосфинотрицинацетилтрансфераза, кодируемая этими генами, обеспечивала детоксикацию |
| Цианамид | Устойчивые растения табака получали при введении гена цианамидгидратазы из гриба Myrothecium verrucaria. Фермент, кодируемый этим геном, катализирует превращение цианамида в мочевину |
| Далапон | Растения табака трансформировали геном дегалогеназы Pseudomonas putida, которая обеспечивала детоксикацию |
роксибензонитрила) — гербицида, который ингибирует фотосинтез. Устойчивые растения создавали путем введения в их геном бактериального гена, кодирующего нитрилазу, которая инактивирует бромоксинил еще до того, как он начинает действовать (рис. 18.10). Из почвенной бактерии Klebsiella ozaenae был выделен ген нитрилазы, помещен под контроль светочувствительного промотора гена малой субъединицы

|
| Рис. 18.10. Инактивация гербицида бромоксинила при помощи нитрилазы К. ozaenae. |
рибулозобисфосфат-карбоксилазы и встроен в геном табака. Трансгенные растения синтезировали активную нитрилазу и были устойчивы к бромоксинилу.
Растения, устойчивые к грибам и бактериям
Фитопатогенные грибы наносят весьма ощутимый вред сельскохозяйственным культурам. По оценкам, убытки, которые терпят фермеры Юго-Восточной Азии, Японии и Филиппин в результате поражения грибом, вызывающим пирикуляриоз, одного из основных зерновых этого региона, риса, исчисляются примерно 5 млрд. долл. в год. Сейчас основной способ борьбы с фитопатогенными грибами состоит в обработке растений химическими веществами, которые накапливаются в окружающей среде и представляют опасность для животных, в том числе и для человека. Поэтому очень важно выработать другие, простые, недорогие, эффективные и безопасные для окружающей среды нехимические методы защиты сельскохозяйственных культур от грибов.
402 ГЛАВА 18
|
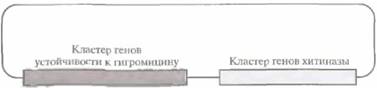
| Рис. 18.11. Плазмидный вектор, содержащий кластер генов хитиназы риса и кластер генов устойчивости к гигромицину, использовавшийся для трансформации протопластов риса. Трансформацию осуществляли обработкой протопластов полиэтиленгликолем в присутствии плазмидного вектора. Затем отбирали клетки, устойчивые к гигромицину, и проводили тестирование клеток на наличие генов хитиназы с помощью гибридизации по Саузерну и на наличии самой хитиназы методом Вестерн-блоттинга, Далее из клеток регенерировали целые растения. |
Часто в ответ на проникновение патогенов растения начинают синтезировать группу специфических PR-белков (от англ, pathogenesis-related proteins). В эту группу входят р-1,3-глюканаза, хитиназа, тауматинподобные белки (тауматин — небольшой, очень сладкий белок) и ингибиторы протеиназ; все они так или иначе воздействуют на патогены. Имея это в виду, ученые попытались вывести растения, устойчивые к болезнетворным грибам, способные конститутивно экспрессировать гены одного или нескольких PR-белков, Так, были получены трансгенные растения, синтезирующие в большом количестве хитиназу, фермент, гидролизующий β-1,4-связи в молекуле N-ацетил-D-глюкозамина, основного компонента клеточной стенки грибов (рис. 18.11).
Среди таких растений были рис, табак и канола. Соответствующие гены, введенные в растительный геном, были поставлены под контроль 358-промотора вируса мозаики цветной капусты. Кроме того, были созданы трансгенные растения табака, которые конститутивно синтезировали не только хитиназу, но и ß-глюканазу. Такие растения были получены скрещиванием одного трансгенного растения, экспрессирующего ген хитиназы, с другим, экспрессирующим ген ß-глюканазы. Трансгенные растения, синтезирующие хитиназу, были более устойчивы к болезнетворным грибам, чем контрольные, даже при том, что последние синтезировали собственные PR-белки в ответ на инфицирование грибами. Кроме того, при этом способность полезного гриба Glomus mosseae закрепляться на корнях растений никак не нарушалась. Возможно, это связано с различиями в составе клеточных стенок данных грибов. Существенно, что трансгенные растения, конститутивно синтезирующие хитиназу, не были подвержены грибковым заболеваниям в полевых условиях. По-видимому, описанный подход окажется весьма эффективным способом защиты растений от патогенных грибов.
По оценкам, ущерб, наносимый урожаю картофеля в результате поражения этой культуры патогенной почвенной бактерией Erwinia carotovora, составляет примерно 100 млн. долл. в год. Положение усугубляется тем, что у растений не выявлено никаких способов защиты от данной инфекции, которые можно было бы использовать для выведения устойчивых коммерческих сортов. Чтобы решить эту проблему, группа исследователей вывела трансгенные растения картофеля, активно экспрессирующие ген лизоцима бактериофага Т4, При этом лизоцим секретировался в апопласт (межклеточное пространство), компартмент, в который проникает и где распространяется E. carotovora. Чтобы обеспечить специфичность секреции, к гену лизоцима фага Т4 была «пришита» последовательность, кодирующая сигнальный пептид α-амилазы ячменя, и ген помещен под транскрипционный контроль 35S-промотоpa вируса мозаики цветной капусты, сигнала терминации транскрипции и сайта полиаденилирования. Хотя ген лизоцима находился под контролем столь сильного промотора, синтезировалось лишь очень небольшое количество лизоцима. Однако трансгенные растения, геном которых содержал такую конструкцию, оказались устойчивыми к большим количествам E. carotovora и в лабораторных условиях, и в оранжерее. В естественных условиях эти болезнетворные бактерии присутствуют в гораздо меньших количествах, чем те, которые ис-
Генная инженерия растений: применение 403

| |
| Светоиндуцируемая экспрессия химерного гена, введенного в Nicotiana tabacum с помощью Ti-плазмидного вектора | |
| L. Herrera-Estrelia, G. Van den Broeck, R. Maenhaut, M. Van Montagu, J. Schell, M. Timko, A. Cashmore Na/ure3W: 115-120, 1984 |
| С разработкой Ti-плазмидной системы трансформации растений у исследователей появилась возможность введения в них чужеродных генов с целью синтеза различных ценных белковых продуктов. Вначале большинство генов, вводимых в растительные клетки, находились под транскрипционным контролем сильного конститутивного 35S-промотора вируса мозаики цветной капусты или немного менее сильного конститутивного промотора гена нопалинсинтазы, содержащегося в некоторых Т-ДНК. Однако для получения растений с новыми полезными признаками часто бывает необходимо, чтобы специфические белки синтезировались только в определенной тка- | ни, например в листьях или корнях, или только на определенной стадии развития растения, например во время развития проростка, образования плода или в условиях высокотемпературного стресса. Первый шаг к выведению таких растений был сделан Херрера-Истреллой с сотрудниками, которые сконструировали химерный ген, содержащий следующие элементы: 5 '-фланкирующий участок гена малой субъединицы рибулозо-бифосфат-карбоксилазы гороха; колирующий участок бактериального гена хлорамфеникол-ацетил-трансферазы; 3'-фланкирующий участок гена нопалинсинтазы, содержащий сигналы терминации транскрипции и полиаденилиро- | вания мРНК. Обычно ген малой субъединицы рибулозобисфосфат-карбоксилазы экспрессируется только в зеленых или фотосинтезирующих тканях; как и ожидалось, там же экспрессировался ген хлорамфеникол-ацетилтрансферазы. Это была одна из первых работ, показавших, что, несмотря на всю свою сложность, растительные промоторы способны обеспечивать синтез гетерологичных белков в строго определенных тканях. Впоследствии разнообразные растительные промоторы широко использовались для регуляции экспрессии гетерологичных генов в трансгенных растениях в нужных тканях и на определенных стадиях развития. |
пользовались в лабораторных испытаниях, так что есть надежда, что упомянутая генетическая конструкция сможет обеспечить надежную защиту растений. Кроме того, поскольку лизоцим лизирует различные грамположительные и грамотрицательные бактерии, этот подход можно будет использовать для защиты растений от самых разных болезнетворных бактерий.
Получение растений, противостоящих неблагоприятным воздействиям и старению
В отличие от большинства животных, растения физически не могут защитить себя от неблагоприятных воздействий со стороны окружающей среды; высокой освещенности, ультрафиолетового облучения, высоких температур и концентрации солей и т. д., поэтому в процессе эволюции у них выработались физиологические механизмы противодействия экстремальным условиям. Одним из нежелательных последствий физиологического стресса является образование радикалов
кислорода. Разумно было предположить, что если удастся создать растения, толерантные к большим концентрациям радикалов кислорода, то такие растения смогут противостоять различным неблагоприятным воздействиям.
Окислительный стресс
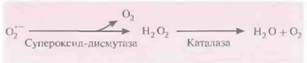
Наиболее распространенным радикалом кислорода, представляющим опасность для растений, является супероксид-анион. Фермент супероксиддисмутаза нейтрализует это соединение, превращая его в пероксид водорода, который в свою очередь превращается в воду любой из множества клеточных пероксидаз или каталаз (рис. 18.12). В одном из экспериментов были получены трансформированные растения табака, несущие ген супероксиддисмутазы под контролем 358-промотора вируса мозаики цветной капусты. Они синтезировали супероксиддисмутазу и были устойчивы к повреждающему действию радикалов кислорода.
У растений имеются несколько изоформ супероксиддисмутазы. Cu/Zn-супероксиддис-
404 ГЛАВА 18
|
| Рис. 18.12. Превращение супероксид-аниона в пероксид водорода, а затем в воду и кислород. |
мутазы содержатся главным образом в хлоропластах и в небольшом количестве в цитозоле. Mn-супероксид-дисмутазы локализуются в митохондриях, а некоторые растения синтезируют Fe-супероксид-дисмутазу. Трансгенные растения табака, несущие «ДНК хлоропластом Cu/Zn-супероксид-дисмутазы под контролем 358-промотора вируса мозаики цветной капусты, были гораздо более устойчивы к яркому свету, чем нетрансформированные растения. Обнаружилось, что фотосинтетическая активность у трансгенных растений сохранялась на 94% в условиях, при которых нетрансформированные растения полностью ее утрачивали. Трансгенные растения, синтезирующие Мn-супероксиддисмутазу, аккумулирующуюся в хлоропластах, были в три-четыре раза менее чувствительны к повреждающему действию озона, чем контрольные нетрансформированные.
Повышение уровня супероксиддисмутазы дает еще одно преимущество: растения становятся более устойчивыми к гербициду метилвиологену и к световому воздействию. Супероксид-дисмутаза способствует также сохранению срезанных цветов при транспортировке. Их увядание тоже происходит в результате образования радикалов кислорода. Если бы удалось создать трансгенные растения, содержащие ген супероксид-дисмутазы, который находится под контролем промотора, специфичного для цветков, это могло бы отсрочить их увядание.
Солевой стресс
Многие растения произрастают в регионах, где часто бывают засухи или где сильно засолена почва. Чтобы приспособиться к этим условиям, они синтезируют низкомолекулярные нетоксичные вещества — осмопротекторы. Эти вещества способствуют поглощению и удержанию воды, а также предотвращают разрушение мак-
ромолекул, присутствующих в клетках растений, под действием высоких концентраций солей. Осмопротекторами являются такие хорошо известные соединения, как сахара, спирты, пролин и четвертичные соединения аммиака. Одним из высокоактивных осмолитиков является бетаин, который накапливается в некоторых растениях во время засухи или при высокой засоленности.
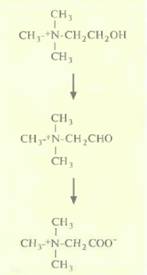
Некоторые важные сельскохозяйственные культуры, в том числе картофель, рис, томаты, не способны накапливать бетаин. Защитить такие растения можно было бы введением в них генов, кодирующих ферменты биосинтеза бетаина. Как у растений, так и у бактерий бетаин синтезируется из холина в две стадии (рис. 18.13). У таких растений, как шпинат, превращение холина в бетаинальдегид катализируется холинмонооксигеназой, а последующее превращение в бетаин — бетаинальдегид-дегидрогеназой. У бактерий типа Е. соli обе стадии катализируются одним ферментом — холиндегидрогеназой. Поэтому при создании солеустойчивых сортов табака была использована A. tumefaciens для трансформации растительных клеток вектором на основе Ti-плазмид, несущим ген betA Ε. соli, который кодирует холиндегидрогеназу; ген находился под контролем 35S-промотора вируса мозаики
|
| Рис. 18.13. Превращение холина в бетаин. |
Генная инженерия растений: применение 405
цветной капусты. Растения, в которых экспрессировался ген betA E. coli, были на 80% более устойчивы к высоким концентрациям солей (примерно 300 мМ), чем нетрансформированные контрольные. По-видимому, осмозащиту можно еще более повысить, если использовать для контроля экспрессии гена betA тканеспецифический промотор.
Созревание плодов
Серьезной проблемой при транспортировке фруктов и овощей является их преждевременное созревание и размягчение. Установлено, что при созревании плодов в растениях активируются специфические гены, кодирующие ферменты целлюлазу и полигалактуроназу, и если подавить экспрессию одного или нескольких из них, то созревание может начаться позже. Для инактивации указанных генов были созданы трансгенные растения, в которых синтезировались антисмысловые РНК-версии этих генов. При введении гена, кодирующего антисмысловую полигалактуроназную РНК, в растения томата — культуры, ежегодно приносящей в США 1,3 млрд. долл. прибыли, — и количество соответствующей мРНК, и активность фермента уменьшились на 90%. Такие генетически трансформированные томаты известны как FLAVR SAVR. 18 мая 1994 г. Департамент по контролю за качеством пищевых продуктов, медикаментов и косметических средств США пришел к выводу, что томаты FLAVR SAVR столь же безопасны, как и полученные обычным скрещиванием, а потому при их продаже нет необходимости указывать их происхождение.
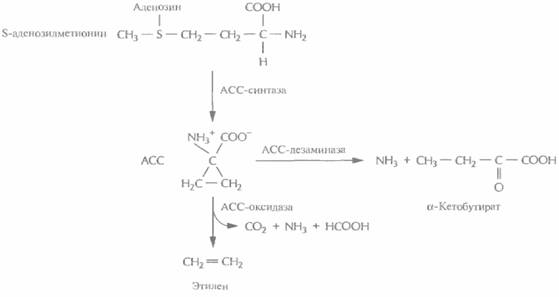
Регулятор роста растений этилен иницирует экспрессию множества генов, ответственных за созревание и старение плодов. Он синтезируется из S-аденозилметионина с образованием промежуточного продукта, 1-аминоциклопропан-1-карбоновой кислоты (АСС) (рис. 18.14). Обработка растений химическими препаратами, блокирующими синтез этилена, задерживает и созревание плода, и старение. Таким образом, преждевременное созревание плода можно пре-
|
| Рис. 18.14. Ингибирование биосинтеза этилена с помошью генетических манипуляций. В норме 1 -аминоциклопропан-1-карбоновая кислота (АСС) синтезируется из S-аденозилметионина с помощью АСС-синтазы, затем АСС-оксидаза катазилирует его превращение в этилен. Синтез этилена можно блокировать, создав трансгенные растения, синтезирующие антисмысловые версии мРНК либо АСС-синтазы, либо АСС-оксидазы. Можно также ввести в растение ген АСС-дезаминазы, которая конкурирует с АСС-оксидазой за свободный АСС, катализируя образование аммиака и α-кетобутирата вместо этилена. |
406 ГЛАВА 18
дотвратить подавлением способности растения синтезировать этилен. Для этого можно использовать разные подходы (рис. 18.14). Так, были созданы трансгенные растения, синтезирующие антисмысловые версии мРНКлибо АСС-синта-зы, либо АСС-оксидазы, ферментов, необходимых для синтеза растением этилена. У таких растений уровень этилена был гораздо ниже нормы, а потому плоды имели длительный срок хранения.
Кроме того, при помощи скрининга было идентифицировано большое количество штаммов почвенных бактерий, разрушающих АСС. Ген фермента АСС-дезаминазы, выделенный из одного такого штамма, был помещен под контроль 35S-промотора вируса мозаики цветной капусты и встроен в геном томата. Полученные растения синтезировали меньше этилена, чем нормальные, а их плоды тоже имели гораздо более длительный срок хранения. Большинство работ по выведению трансгенных растений с пониженным содержанием этилена касаются томатов, но имеется одно сообщение о создании трансгенной мускусной дыни с такими же свойствами. Все эти данные говорят о том, что данный подход может быть весьма результативным применительно к различным плодовым культурам.
Изменение окраски цветков
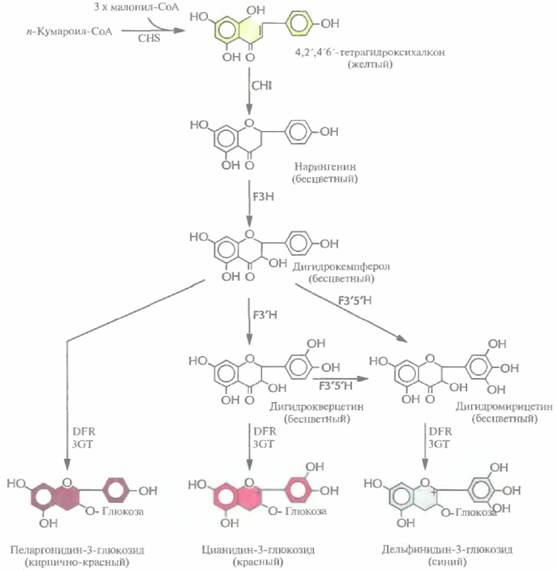
Цветоводы все время стараются создавать растения, цветки которых имеют более привлекательный внешний вид и лучше сохраняются после того, как их срежут. С помощью традиционных методов скрещивания за многие годы были выведены тысячи новых сортов, отличающихся друг от друга цветом и формой цветков. Однако скрещивание растений — это кропотливая процедура, требующая много времени и имеющая свои ограничения, связанные с генным пулом конкретного вида; поэтому, например, никому не удалось вывести синюю розу. В качестве альтернативы для выведения цветов с необычной окраской можно использовать методы, основанные на манипуляциях с генами ферментов биосинтеза антоцианинов. Антоцианины, соединения класса флавоноидов, являются наиболее распространенными пигментами цветков. Они синтезируются из аминокислоты фенилаланина в ходе нескольких ферментативных реакций. Окраска цветка определяется химическими свойствами их боковой цепи, при этом производные цианидина ответственны за красный цвет, а производные дельфинидина зa синий (рис. 18.15).
Дигидрофлавонол-4-редуктаза петуньи катализирует превращение бесцветного дигидро-кверцетина в цианидин-3-глюкозид, соединение красного цвета, а бесцветного дигидромирицетина — в синий дельфинидин-3-глюкозид, но не может использовать в качестве субстрата бесцветный дигидрокемпферол (рис, 18.15). Однако после трансформации петуньи геном дигидрофлавонол-4-редуктазы кукурузы ее цветки приобретают кирпично-красную окраску. Этот необычный цвет, никогда ранее у петуний не наблюдавшийся, обусловлен синтезом в трансгенном растении пеларгонидин-3-глюкозида из дигидрокемпферола.
Примерно 70% объема индустрии цветоводства приходится на долю четырех растений: роз, гвоздик, тюльпанов и хризантем, поэтому все усилия по получению генетически трансформированных растений с цветками измененной окраски были направлены на работы именно с этими растениями. Например, были выведены трансгенные хризантемы, несущие смысловые и антисмысловые конструкции кДНК халконсинтазы. Этот фермент катализирует первую стадию биосинтеза антоцианина (рис. 18.15), Ученые исходили из того, что и смысловые, и антисмысловые кДНК будут подавлять экспрессию гена халконсинтазы в трансгенных растениях. «Смысловая супрессия», называемая также «косупрессией», состоит в том, что в присутствии дополнительной копии эндогенного гена подавляется накопление соответствующей мРНК. Молекулярные основы этого явления до настоящего времени не установлены. Антисмысловая же РНК халконсинтазы блокирует трансляцию эндогенной халконсинтазной мРНК.
Смысловые и антисмысловые конструкции, находящиеся под контролем 35S-промотора вируса мозаики цветной капусты, были встроены в бинарный вектор на основе Ti-плазмид и введены в клетки растений. У трех из 133 «смысловых» трансформантов и трех из 83 «антисмысловых» цветки были белыми, что указывало на подавление экспрессии эндогенного гена халконсинтазы,
Генная инженерия растений: применение 407
|
| Рис. 18.15. Биосинтез антоцианинов. Сокращения: CHS — халконсинтаза, CHI — халконизомераза, F3H - флавонон-3-гидроксилаза, F3'Н — флавоноид-3'-гидроксилаза, F3'5'H - флавоноид-3'5'-гидроксилаза, DFR -дигидрофлавонол-4-редуктаза, 3GT— UDP-глюкоза: флавоноид-3-О-глюкозилтрансфераза. DFR петуньи способна катализировать превращение дигидрокверцетина в цианидин-3-глюкозид, а дигидромирицетина — в дельфинидин-3-глюкозил, соединение синего цвета. DFR кукурузы катазилирует синтез из дигидрокемпферола пелартнидин-3-глюкозида, соединения кирпично-красного цвета. |
т. е. подавление синтеза антоцианина. Растения с белыми цветками вегетативно размножались черенками в полевых условиях и примерно у 90—98% из них продолжали образовываться белые, а не розовые цветки. Эта paботa является важной вехой в выведении новых сортов цветов с необычной окраской, представляющих коммерческий интерес.
Изменение пищевой ценности растений
За многие годы агрономы и селекционеры достигли больших успехов в улучшении качества и повышении урожайности самых разных сельскохозяйственных культур. Однако традиционные методы выведения новых сортов растений,
408 ГЛАВА 18
основанные на их скрещивании, весьма трудоемки и требуют много времени, а их возможности ограничены вследствие ограниченности набора генов у скрещиваемых линий. Генноинженерные методы не только позволяют ускорить процесс получения растений с улучшенными свойствами, но и создавать сорта с новыми признаками, которые невозможно было бы передать растениям с помощью традиционных методов скрещивания. Например, в лабораторных условиях уже получены такие культуры с улучшенными пищевыми качествами, как кукуруза и горох. При этом был изменен аминокислотный состав некоторых запасных белков их семян. Кроме того, созданы сорта масличных культур (как пищевых, так и непищевых) с измененным жирнокислотным составом плодов, а также предпринята попытка улучшить вкус фруктов путем введения в растения гена мо-неллина, белка, имеющего сладкий вкус.
Аминокислоты
Запасные белки, которые служат источниками углерода и азота прорастающих семян, состоят из ограниченного повторяющегося набора аминокислот. Пищевая ценность этих белков невелика, поскольку в них отсутствуют одна или несколько незаменимых аминокислот (обычно лизин или метионин). Аминокислотный состав запасных белков семян можно немного изменить обычным скрещиванием, а недавно для этих целей были использованы генноинженерные методы.
В одном из предварительных экспериментов в растения табака был введен ген фазеолина из фасоли, кодирующий запасной белок, который состоит из самых разных аминокислот. Ген эффективно экспрессировался, а белковый продукт доставлялся в нужный компартмент. Кроме того, специфически изменив in vitro нуклеотидную последовательность генов запасных белков семян, можно было синтезировать белок с нужным аминокислотным составом. Если аминокислотные замены происходят вблизи гипервариабельной области С-концевого участка молекулы, то ее структура не нарушается. Правильная укладка цепи остается и при прорастании семян.
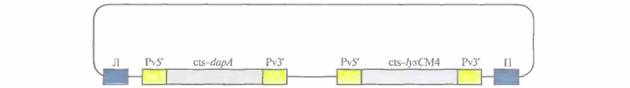
Чтобы увеличить содержание лизина в семенах, была предпринята попытка нарушить регуляцию его биосинтеза. Аминокислоты лизин, треонин, метионин и изолейцин синтезируются из аспартата (рис. 18.16) в несколько этапов. Первый этап состоит в фосфорилировании аспартата аспартаткиназой (АК) с образованием ß-аспартилфосфата. Далее, при биосинтезе лизина, происходит конденсация аспарагинового ß-полуальдегида с пировиноградной кислотой, катализируемая синтазой дигидродипиколиновой кислоты (DNDPS). Регуляция обеих ферментативных активностей (АК и DNDPS) осуществляется с помощью лизина по принципу обратной связи, которую нужно разорвать, чтобы синтез лизина ничем не ограничивался. Для этого использовали гены DNDPS и АК, не чувствительные к ингибированию лизином, из Corynebacterium и Е. coli соответственно. К каждому из этих генов «пришивали» нуклеотидную последовательность, кодирующую лидерный пептид, транспортирующий белки в хлоропласты, снабжали каждый из генов семяспецифичным промотором и вводили их в растения канолы и сои в составе бинарного вектора на основе Ti-плазмид (рис. 18.17). В семенах трансгенных растений содержалось в 100 раз больше свободного лизина, чем в семенах обычных растений; при этом содержание лизина во всех белках семян канолы было в два раза больше, а в белках сои — в пять раз.
Когда кукуруза используется в качестве корма для скота, к ней добавляют соевую муку и очищенный лизин. Однако вместо того чтобы использовать дорогостоящий лизин, можно добавлять к кукурузе дешевую соевую муку, полученную из трансгенных растений сои, которые синтезируют в больших количествах лизин. Возможно, используя этот подход, успешно примененный на сое, удастся вывести сорт кукурузы, в семенах которой повышено содержание лизина. Такая кукуруза имела бы большую пищевую ценность.
Липиды
По оценкам, в 1995 г, во всем мире было выработано растительного масла на сумму примерно 45 млрд. долл., а к 2010 г. эта величина составит
Генная инженерия растений: применение 409
| Рис. 18.16. Схема биосинтеза аминокислот — производных аспартата (здесь представлены не все реакции и промежуточные продукты). Штриховыми стрелками показано ингибирование по принципу обратной связи. DHDPS -синтаза дигидродипиколиновой кислоты, АК — аспартаткиназа. | 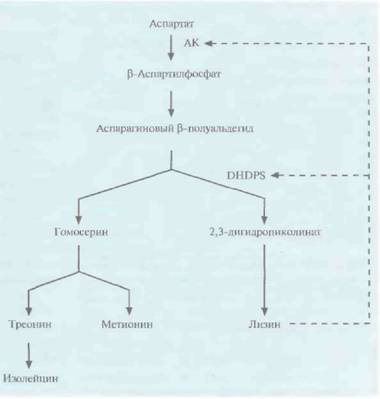
|
|
| Рис. 18.17. Ti-плазмидный вектор, использующийся для трансформации сои и канолы с целью повышения содержания лизина в этих растениях. Pv5' — промотор гена ß-фазеолина бобов, Pv3' — сигнал терминации транскрипции гена ß-фазеолина бобов, cts - последовательность, кодирующая сигнальный хлоропластный пептид малой субъединицы рибулозобисфосфат-карбоксилазы, dарА — ген Corynebacterium, кодирующий синтезу дигидродипиколиновой кислоты, не чувствительной к лизину, lysCM4 — мутантный ген lys C E. coli, кодирующий не чувствительную к лизину аспартаткиназу, Л и Π —левая и правая фланкирующие последовательности Т-ДНК соответственно. |
С помощью генной инженерии можно изменять степень ненасыщенности (т. е. число двойных связей С=С) и длину цепи этих кислот. Было создано и проверено в полевых условиях множество трансгенных сортов канолы, которые синтезировали масла с измененным жирно-кислотным составом (табл. 18,6). Каждый трансгенный сорт содержал один Дополнительный ген. Например, растения, синтезирующие в
70 млрд. долл. Более 90% масла расходуется на производство маргарина, жиров, масла для са-лата и для жарки. Примерно 75% всех масличных культур приходится на долю сои, пальмы, рапса (канолы) и подсолнечника, а получаемые из них масла состоят главным образом из следующих жирных кислот: пальмитиновой, стеариновой, олеиновой, линолевой и линоленовой (табл. 18.5).
410 ГЛАВА 18
| Таблица 18.5. Некоторые важные растительные жирные кислоты | |
| Тривиальное название | Сокращенное обозначение 1) |

| |
| '' Первая цифра в индексе при С означает число атомов углерода, вторая — степень ненасыщенности, т. е. число двойных связей С— С; значок Δ с последующим числом обозначает номер первого атома углерода, который образует связь С=С; число перед ОН указывает положение боковой гидроксильной группы Все связи С=С — цис. В системе нумерации атомов, пришлой для жирных кислот, номер 1 присваивают карбоксильной группе. |
большом количестве стеариновую кислоту, несли антисмысловую копию гена стеаратдесатуразы Brassica;при этом подавлялась экспрессия нормального гена канолы, что приводило к накоплению стеариновой кислоты, которая обычно превращалась в олеиновую. Успехи, достигнутые в получении трансгенных сортов канолы, позволяют надеяться, что в будущем этот подход найдет широкое применение и позволит создать новые, представляющие коммерческую ценность сорта.
Изменение вкуса и внешнего вида плодов
Изменение внешнего вида
Изменение цвета собранных овощей и фруктов создает серьезные проблемы при их реализации. Один из способов борьбы с изменением внешнего вида пищевых продуктов состоит в использовании различных пищевых добавок, что, впрочем, создает другие проблемы. Так, недавно возникли сомнения относительно безопасности одного из видов добавок — сульфитов.
Изменение цвета овощей и фруктов начинается с окисления монофенолов и о-дифенолов до о-хинонов. Катализатором процесса служат ферменты полифенолоксидазы. Они кодируются ядерной ДНК, имеют мол. массу примерно 59 000 и локализуются в мембранах хлоропластов и митохондрий.
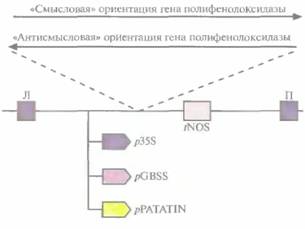
Предположение о том, что ингибирование полифенолоксидазы поможет решить проблему изменения цвета плодов, было проверено на трансгенном картофеле, несущем различные кДНК-конструкции полифенолоксидазы. Были созданы векторы, содержащие фрагмент или полноразмерную кДНК полифенолоксидазы картофеля в «смысловой» или «антисмысловой» ориентации, которые находились под контролем одного из трех промоторов: 355-промстора вируса мозаики цветной капусты, промотора гена синтазы гранулосвязанного крахмала или промотора гена пататина (рис. 18.18). Последние два промотора специфичны для клубней картофеля. Два коммерческих сорта картофеля,
| Таблица 18.6. Трансгенные сорта канолы с измененным жирнокислотным составом семян1) | ||
| Содержание жирных кислот | Изготавливаемые продукты | Время проведения первых полевых испытаний |
| 40% стеариновой | Маргарин, шоколадное масло | |
| 40% лаури новой | Детергенты | |
| 60% лаури новой | Детергенты | |
| 80% олеиновой | Пищевые продукты, смазочные материалы, чернила | |
| Петрозелиновая | Полимеры, детергенты | |
| Воск симмондсии китайской (хохоба) | Косметика, смазочные материалы | |
| 40% миристиновой | Детергенты, мыла, предметы личной гигиены | |
| 90% эруковой | Полимеры, косметика, чернила, фармацевтические препараты | |
| Рицинолеиновая | Смазочные материалы, пластификаторы, косметика, фармацевтические препараты | |
| 1) По данным работы Murphy, Trends BiotechnoL 14:206-213, 1996. |
Генная инженерия растений; применение 411
|
| Рис. 18.18. Конструкции со «смысловой» и «антисмысловой" ориентациями гена полифенолоксидазы. Транскрипция в обоих случаях осуществлялась под контролем одного из промоторов: 35S-промотора вируса мозаики цветной капусты (p35S), промотора гена синтазы гранулосвязанного крахмала (рС BSS) или промотора гена пататина 1 (pPATATIN), а также сигнала терминации транскрипиии гена нопалинсинтазы (tNOS). Л и Π — левая и правая фланкирующие последовательности Т-ДНК соответственно. (По данным работы Bachern et al., Bio/Technology 12: 1101-1105, 1994.) |
трансформированные этими конструкциями, были высокоустойчивы к черной пятнистости (ферментативное изменение цвета), причем уровень устойчивости был гораздо выше, чем тот, которого удавалось достичь при обычном скрещивании. Трансгенные растения, несущие кДНК полифенолоксидазы, преднамеренно повреждали, а затем оценивали их устойчивость к черной пятнистости. Большинство трансгенных растений, в геноме которых присутствовал ан-тисмысловой вариант гена полифенолоксидазы, находящегося под контролем либо 35S-промотора вируса мозаики цветной капусты, либо промотора гена синтазы гранулосвязанного крахмала, были значительно более устойчивы, чем нетрансформированные. Активность промотора гена пататина в клубнях картофеля, по-видимому, проявлялась лишь частично, и накопление полифенолоксидазы не блокировалось. Все растения, содержащие смысловые конструкции, синтезировали полифенолоксидазу в большем количестве и были подвержены поражениям в большей степени, чем контрольные. Хотя все эти результаты носят сугубо предварительный характер, описанный подход может оказаться полезным для борьбы с ферментативным изменением цвета плодов различных коммерчески ценных растений.
Изменение вкуса
Невкусные фрукты и овощи вряд ли будут пользоваться покупательским спросом, даже если они имеют высокую пищевую ценность. Конечно, вкус пищевых продуктов можно улучшить в процессе приготовления добавлением соли, сахара, ароматизаторов или других добавок, однако с экономической точки зрения было бы лучше, если бы пищевые продукты исходно обладали необходимыми вкусовыми качествами и выглядели более аппетитно.
В плоде африканского растения Dioscorephyllum cumminsii Diels содержится белок монеллин, примерно в 100 000 раз более сладкий, чем сахароза в эквимолярных количествах. Этот белок вполне может служить заменителем сахара, обладающим еще и тем преимуществом, что, не являясь углеводом, он не должен оказывать вредного воздействия на метаболизм.
Монеллин — это двухцепочечный димер; А-цепь состоит из 45 аминокислотных остатков, B-цепь — из 50. Цепи связаны между собой слабыми нековалентными связями, и это ограничивает его применение в качестве подсластителя, поскольку при нагревании в процессе приготовления пищи или под действием кислот (например, лимонной или уксусной) он легко диссоциирует и теряет свои вкусовые качества, Задача создания трансгенных растений или микроорганизмов, способных синтезировать монеллин, усложняется тем, что необходимо клонировать и координированно экспрессировать два отдельных гена. Чтобы решить эту проблему, был химически синтезирован ген монеллина, кодирующий А- и B-цепи как один полипептид. Были созданы трансгенные растения томата и салата, синтезирующие химерный белок. Для этого использовали два разных промотора. В случае томатов это был Е8-промотор, специфичный для плодов и активизирующийся в самом начале их созревания. В растениях салата ген находился под контролем 35S-промотора вируса мозаики цветной капусты. В обоих случаях использовались сайты терминации
412 ГЛАВА 18
транскрипции/полиаденилирования гена нопалинсинтазы в составе Ti-плазмиды. Синтетический ген монеллина вводили в растительные клетки инфицированием их A. tumefaciens, используя коинтегративную векторную систему на основе Ti-плазмид. Монеллин был обнаружен в зрелых и частично зрелых плодах и в листьях салата, но не в зеленых помидорах, при этом его содержание в томатах повышалось при резком повышении концентрации растительного гормона этилена. Сообщения о всесторонних испытаниях вкусовых качеств генетически подслащенных пищевых продуктов пока отсутствуют, но если результаты окажутся положительными, то описанный способ подслащения плодов можно будет использовать для многих культур.
Растения как биореакторы
Растения дают большое количество биомассы, а выращивание их не составляет труда, поэтому разумно было попытаться создать трансгенные растения, способные синтезировать коммерчески ценные белки и химикаты. В отличие от ре-комбинантных бактерий, которых культивируют вбольш их биореакторах (при этом необходимы высококвалифицированный персонал и дорогостоящее оборудование), для выращивания сельскохозяйственных культур не нужно больших средств и квалифицированных рабочих. Основная проблема, которая может возникнуть при использовании растений в качестве биореакторов, будет связана с выделением продукта введенного гена из массы растительной ткани и сравнительной стоимостью производства нужного белка с помощью трансгенных растений и микроорганизмов. Уже созданы экспериментальные установки по получению с помощью растений моноклональных антител, функциональных фрагментов антител и полимера поли-р-гидроксибутирата, из которого можно изготавливать материал, подверженный биодеградации,
Антитела
Производство антител и их фрагментов с помощью трансгенных растений имеет ряд преимуществ перед их синтезом в клетках рекомбинантных микроорганизмов. Трансформация растений носит стабильный характер, чужеродная ДНК практически необратимо встраивается в растительный геном, в то время как большинство микроорганизмов трансформируются плазмидами. которые могут утрачиваться в ходе длительной или крупномасштабной ферментации. Кроме того, процессинг и укладка чужеродных белков в растениях аналогичны таковым в животных клетках, в то время как в бактериях процессинг, укладка и посттрансляционные модификации эукариотических белков затруднены. Кроме того, крупномасштабное выращивание растений не требует больших затрат и не лимитируется возможностями процессов ферментации. И наконец, можно создать условия, при которых чужеродные белки будут синтезироваться в семенах, где их целостность не нарушится длительное время.
Полимеры
Крупномасштабный бактериальный синтез поли-β-гидроксибутирата, полимера, из которого получают пластик, подверженный биодеградации, обходится довольно дорого. Поэтому интересно было выяснить, можно ли получать этот полимер с помощью трансгенных растений, В бактериях типа Alcaligenes eutrophus поли-β-гидроксибутират синтезируется из ацетил-СоА в три стадии, катализируемые тремя ферментами (см. рис. 12.22), гены которых входят в один оперон. Растения неспособны процессировать транскрипт оперо-на с более чем одним геном, поэтому каждый из генов был клонирован по отдельности и встроен в хлоропластную ДНК растения Arabidopsis thaliana. Хлоропласты были выбраны потому, что, как показали выполненные ранее эксперименты, в цитоплазме полимер синтезировался в небольшом количестве, при этом большинство растений были чахлыми. Кроме того, в хлоропластах может накапливаться другой биополимер — крахмал.
К каждому из трех генов поли- β -гидроксибутирата были присоединены фрагменты ДНК, кодирующие хлоропластную сигнальную последовательность малой субъединицы рибулозобисфосфат-карбоксилазы гороха, и каждый ген был помещен под транскрипционный контроль 35S-промотора вируса мозаики цветной капус-
Генная инженерия растений: применение 413
ты. Гены были введены в растения A. thaliana в составе бинарных векторов на основе Ti-плазмид. Два трансгенных растения, каждое со своим чужеродным геном, скрещивали, чтобы получить растения с двумя чужеродными генами, включенными в хлоропластную ДНК. Затем трансгенное растение с двумя чужеродными генами скрещивали с растением, несущим третий чужеродный ген, и отбирали растения, несущие все три бактериальных гена поли-β-гидроксибутирата. В зрелых листьях некоторых трансгенных растений, экс-прессирующих все три бактериальных гена, синтезировалось более 1 мг поли-β-гидроксибутирата на I г сырой ткани листа. Эту работу можно считать первым важным шагом в создании сельскохозяйственных культур, которые можно использовать для получения в больших количествах поли-β-гидроксибутирата
Чужеродные белки, аккумулирующиеся в семенах
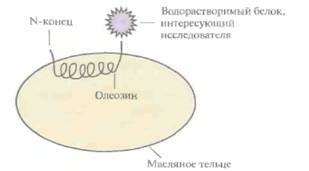
Олеозины, или белки масляных телец, содержатся в семенах различных растений. Они весьма гидрофобны и стабилизируют масляные тельца как дискретные структуры. При этом их N- и С-концевые участки более гидрофильны, чем внутренняя область молекулы, и экспонированы в водное окружение. Используя генную инженерию, можно попытаться создать реком-
|
| Рис. 18.19. Рекомбинантный белок, компонентами которого являются олеозин и водорастворимый белок. Олеозин обладает высоким сродством к масляному тельцу семени растения, а его N- и С-концы, а также второй белок гидрофильны и экспонированы в водное окружение. |
бинантные белки из олеозинов и водорастворимых белков (рис. 18.19): рекомбинантные белки будут аккумулироваться в масляных тельцах, что позволит относительно легко их очистить. При этом водорастворимый белок будет экспонирован в водное окружение, и при необходимости его можно будет отщепить. Это позволяет значительно удешевить процедуру очистки белков, синтезируемых растениями.
ЗАКЛЮЧЕНИЕ
Вводя в геном растений чужеродные гены и обеспечивая их экспрессию, можно относительно быстро создавать новые сорта растений. Уже получены трансгенные растения, устойчивые к неблагоприятным условиям окружающей среды, к насекомым-вредителям, вирусам, гербицидам, окислительному и солевому стрессам. Выведены культуры с необычной окраской цветков, растения, имеющие более высокую пищевую ценность, растения с измененным вкусом плодов и т. д. Некоторые растения удалось модифицировать так, что они стали своеобразными фабриками по крупномасштабному синтезу ценных белков, например антител. Многочисленные трансгенные растения с измененными свойствами и повышенной пищевой ценностью прошли успешную проверку в лабораторных, а некоторые из них — в полевых условиях, К настоящему времени на рынок поступило лишь небольшое число генетически модифицированных растений, однако можно с уверенностью сказать, что в будущем они займут на нем достойное место.
ЛИТЕРАТУРА
Ananda Kumar Р., R. P. Sharma, V.S. Malik.19%, The insecticidal proteins of Bacillus thuringïensis. Adv. Appl. Microbiol. 42:1—43.
Anderson E. J., D. M, Stark, R.S. Nelson, N. E. Turner, R. N. Beaehy.1989. Transgenic plants that express the coat protein gene of TMV or A1MV interfere with disease development of non-related viruses. Phytopathology 12:1284-1290.
414 ГЛАВА 18
Ayub R., M. Guis, M. BenAmor, L. Gillot, J.-P. Roustan, A. Latehé, M.Bouzayen, J.-C. Pech.1996. Expression of ACC oxidase antisense gène inhibits ripening of cantaloupe melon fruits. Nat. Biotechnol. 14:862-866.
Bachern С. W. В., G.-J. Speckmann, P. С. G. van der Linde, F. T. M.Verheggen, M, D. Hunt, J. C.StefTens, M. Zabeau. 1994. Antisense expression of polyphenol oxidase genes inhibits enzymatic browning in potato tubers. Bio/Technology 12: 1101-1105.
Beachy R. N., S. Loesch-Fries, N. E. Turner. 1990.Coat protein-mediated resistance against virus infection. Annu. Rev. PhytopathoL 28: 451-474.
Bird C. R., D. Grierson, J. A. Ray, W. W. Schuch.October 1993. Tomato plants and cells containing рТОМЗб antisense constructs. U.S. patent 5,254,800.
Boulter D., A. M. R. Gatehouse, V, Hilder.1989. Use of cowpea trypsin inhibitor (CpTI) to protect plants against insect prédation, Biotechnol. Adv. 7: 489-498.
Bowler C., L· Stooten, S, Vandenbranden, R. De Rycke, J. Botterman, C. Sybesma, M.Van Montagu, D. Inze,1991. Manganese Superoxide dismutase can reduce cellular damage mediated by oxygen radicals in transgenic plants. EMBQ J. 10: 1723-1732.
Brünfte K. J., R. L. Meeusen. 1991. Insect control with genetically engineered crops. Trends Biotechnol. 9: 197-200.
Cheng J., M. G.Boh/anl, R. C. Saxena, M. B. Sticklen. 1992, Production of insect resistant potato by genetic transformation with a δ-endotoxin from Bacillus thuringiens'ts var. kurstaki. Plant Set. 81: 83-91.
Comai L., D, Facciotti, W. R. Hiatt, G. Thompson, R. E.Rose, D. M. Stalker1985. Expression in plants of a mutant aroA gene from Salmonella typhimurium confers tolerance to glyphosate. Nature 317:741-744.
Corbin D. R., J. T. Greenplate, E. Y. Wong, J. Purcell.1994. Cloning of an insecticidal cholesterol oxidase gene and its expression in bacteria and in plant protoplasts. Appl. Environ. Microbiol. 60:4239-4244.
Courtney-Gutterson N., C, Napoli, C. Lemieux, A.Morgan, E. Firoozabady, K. E. P. Robinson.1994. Modification of flower color in florist's
Chrysanthemum: production of a white-flowering variety through molecular genetics. Bio/Technology 12: 268-271.
Cuozzo M., K. M. O'Connell, W. Kaniewski, R.-X.Fang, N.-H. Chua, N. E. Turner.1988. Viral protection in transgenic tobacco plants expressing the cucumber mosaic virus coat protein or its antisense RNA. Bio/Technology 6: 549-557.
Day A. G., E. R. Bejarano, K. W. Buck, M. Burrell,
C. P. Lichtenstein.1991. Expression of an anti-sense viral gene in transgenic tobacco confers resistance to the DNA virus tomato golden mosaic virus. Proc. Natl. Acad. Sa. USA 88: 6721-6725.
Dekker J., S. O. Duke.1995. Herbicide-resistant field crops. Adv. Agron. 54:69—116.
Detennay X., B. J. LaVaUee, R. K. Proksch, R. L,Fuchs, S. R. Sims, J. T. Gr
Дата добавления: 2015-07-14; просмотров: 1478;
