E. M. Donaldson, P.Swanson, W.-K. Chan. 2 страница
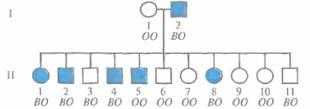
Проиллюстрируем подсчет лод-балла на примере сибсов одной семьи (рис. 20.9). Обозначения В и О на рис. 20,9 соответствуют аллелям АВО* В и АВО*О групп крови системы АВО. Закрашенными символами обозначено аутосомно-доминантное заболевание с полной пенетрантностью -- наследственный онихоартроз (NFS. nail-patella syndrom). Основные признаки NFS — нарушение роста ногтей на пальцах рук и ног и редукция или отсутствие надколенника. Ген NPS обозначается NPS1, а его рецессивный («нормальный») и доминантный («патологический») аллели — NPS1*N и NPS1*D соответственно. NPS представляет собой подходящий для изучения сцепления признак, так как он рано диагностируется, не влияет на жизнеспособность и репродуктивную функцию и присутствует при рождении.
|
| Рис. 20.9. Наследование генов онихоартроза и генов групп крови системы АВО. Закрашенными символами обозначены лица с наследственным онихоартро-зом, незакрашенными — лица, у которых признаки данного заболевания отсутствуют. Буквы под каждым символом обозначают аллели групп крови системы АВО (использованы сокращенные обозначения: О соответствует АВО*О, В - АВО*В). |
Отец 1-2 (рис. 20,9) гетерозиготен по локусу NPS, поскольку среди его детей есть как больные, так и здоровые. Он гетерозиготен и по локусу АВО (АВО*В/АВО*О), так как у его детей встречаются фенотипы О и В, а генотип его супруги (1-1) -- АВО*О/АВО*0. Следовательно, отец дигетерозиготен по этим двум аутосомным локусам (NPS1*N/NPS1*D;ABO*B/ABO*O). Если локусы АВО и NPS1 сцеплены, то фаза, в которой находятся их аллели у отца, неизвестна (состояние с неизвестной фазой). Она может быть как АВО*В NPSI*D/ABO*0 NPS1*N (фаза 1), так и АВО*В NPSI*N/ABO*0 NPS1*D (фаза 2). Или, в сокращенном виде, В D/0 N (фаза 1) или BN/OD (фаза2).
Если предположить, что локусы АВО и NPS сцеплены и их аллели у отца находятся в фазе 1 (АВО*В NPS1*D/ABO*D NPS1*N), то дети II-1, Il-2f 11-4, П-6, II-7, 11-8, II-9 и 11-10 получили от него нерекомбинантную хромосому АВО*В NPS1*D или АВО*О NPS1*N (рис. 20.10). Все дети получили от матери (I-1 ) хромосому АВО*О NPS1*N, поскольку она гомозиготна по двум локусам (АВО*О NPS1*N/ABO*O NPS1*N). В данном случае генетический вклад матери известен и не влияет на анализ сцепления. Исходя из того, что рассматриваемые аллели у отца находятся в фазе 1, каждый из его детей II-3, II-5 и II-11 получил рекомбинантную хромосому. Следовательно, вероятность такого сочетания нерекомбинантных и рекомбинантных хромосом для данной семьи равна
(1-θ)8(θ)3.
Молекулярная генетика человека 449

|
| Рис. 20.10. Генетическая организация аллелей генов онихоартроза и групп крови АВО у членов родословной, приведенной на рис. 20.9, при условии сцепления этих двух локусов. Использованы сокращенные обозначения аллелей групп крови системы АВО: О соответствует АВО*О, а В — АВО*В. Рецессивный («нормальный") и доминантный («патологический») аллели локуса наследственного онихоартроза обозначены N и D соответственно. Генотип отца (1-2) может находиться в любой из двух фаз (фаза 1, фаза 2). Хромосомы отца и хромосомы, унаследованные от него детьми, выделены синим цветом, хромосомы матери (1-1) и хромосомы, унаследованные от нее, - светло-коричневым. Отмечено, какие из хромосом, полученных от отца, являются нерекомбинантными (NR) или рекомбинантными (R) для фазы 1 и фазы 2. |
Рассматриваемые аллели у отца с такой же вероятностью могут находиться в фазе 2, т. е. АВО*В NPS1*N/ABO*O NPS1*D. Тогда дета Н-3, II-5 и II- 1 1 получили от него нерекомбинантные хромосомы, а каждый из оставшихся детей унаследовал рекомбинантную хромосому (рис. 20.10). Вероятность такой комбинации для данной семьи равна (1— θ)3(θ)8.
Поскольку для генотипа отца обе фазы равновероятны, общая вероятность L(θ) наблюдаемой в родословной комбинации хромосом у его детей равна 1/2(1-θ)8(θ)3 + 1/2(1-θ)3(θ)8. Далее находят значение данного выражения для разных θ. Обычно используют следующий набор значений θ : 0; 0,001; 0,05; 0,10; 0,2; 0,3; 0,4 и 0,50, а если нет ограничений во времени, можно взять весь спектр значений θ от 0 до 0,50. Затем вычисляют логарифм отношения вероятности для каждого 0, кроме 0,50, к вероятности для θ = 0,50. Например, для θ = 0,10 отношение L(0,10)/L(0.50) равно

Десятичный логарифм 0,441 равен -0,356; это и есть лод-балл для данного отношения. Другими словами, Z(0,10) = -0,356.
Если фаза, в которой находятся рассматриваемые аллели у отца, известна, то и значение вероятности E(θ) для данной семьи тоже будет известно. Например, если для генотипа 1-2 имеет место фаза 1 (АВО*В NPS1*D/ABO*O NPS1*N), то, как отмечалось выше, вероятность L(θ) для данной семьи будет равна (l-θ)8(θ)3, и Ζ(θ= 0,10) составит

Если же для генотипа 1-2 имеет место фаза 2 (ABO*B NPS1* N/ABO*O NPSI*D), то Z(0,10) будет равен
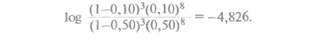
Для состояния с неизвестной фазой значения Z для родословной, приведенной на рис, 20.9, варьируют от -5,993 при θ = 0,001 до +0,029 при
450 ГЛАВА 20
| Таблица 20.1. Значения Z при разных θ для родословной, приведенной на рис. 20.9, в случае состояния с неизвестной фазой |

|
θ— 0,45 (табл. 20,1). Если сибсы получили хотя бы одну рекомбинантную хромосому и θ = 0, то Ζ = – ∞. Как видно из табл. 20.1, лод-балл максимален (Zmax) при θ, близком к 0,30. Проведя дополнительные расчеты для θ от 0,20 до 0,40, получим, что Zmax = +0,214 при θ = 0,276.
Значение Zmax = +0,214 не позволяет с уверенностью говорить о сцеплении локусов АБО и NPS1. Условились, что два аутосомных локуса могут считаться сцепленными только в том случае, если значение максимального лод-балла большее или равно +3,000: вероятность сцепления в этом случае составляет 1000 к 1 или выше. В случае Х-cцепленных генов, заведомо находящихся на одной хромосоме, значение Zmax, при котором можно говорить о сцеплении, больше или равно +2,000; это соответствует шансам в пользу сцепления 100 к 1 или выше. Если Z = —2,000, то сцепление двух локусов исключается, поскольку в этом случае в пользу сцепления существует лишь 1 шанс из 100.
Чтобы выявить сцепление, необходимо подсчитать Z-балл при разных θ дляразных семей и найти максимальное его значение. Преобразование отношения правдоподобий для каждой из семей в десятичный логарифм позволяет суммировать полученные Z(θ), Для определения сцепления локусов АВО и NPS1 было проанализировано 25 родословных, в том числе несколько с большим количеством детей, и получено значение Ζ(0,10) = +31,235 (табл. 20.2); это больше, чем +3,000, следовательно, два указанных локуса сцеплены.
Значение θ, при котором Z достигает максимума, дает грубую оценку рекомбинационного индекса для двух сцепленных локусов. В первой работе по определению сцепления локусов АВО и NPS1 точное значение Zmax не определялось, но Z-балл при θ = 0,10 был наибольшим из всех Ζ, подсчитанных для разных θ, из чего был сделан вывод, что, по-видимому, расстояние между этими двумя локусами составляет примерно 10 сМ. Необходимо подчеркнуть, что при анализе разных родословных с NPS обнаружилось, что с локусом NPS1 сцеплены разные аллели системы АВО. Другими словами, не существует специфического сцепления между конкретным аллелем системы АВО и локусом NPS1. Пока не доказано обратное, можно говорить только о генетическом сцеплении между локусами, а не между определенными аллелями. Следует также отметить, что метод подсчета лод-балла не позволяет определить аутосомную локализацию двух сцепленных локусов. Как мы увидим, для того чтобы установить, что локусы АВО и NPS1 расположены на длинном плече (q) хромосомы 9 между районами 34 и 34.2, т. е. 9q34—9q34.2, потребовались дополнительные исследования.
Построение генетических карт хромосом человека
Генетический полиморфизм
Сцепление между локусом АВО и геном наследственного онихоартроза удалось обнаружить по двум причинам. Во-первых, каждый из основных аллелей системы АВО (1А, IB, 1O) можно точно идентифицировать при помощи простого лабораторного теста, так что генотипы всех исследуемых родителей и детей оказываются известными. Во-вторых, каждый аллель системы АВО встречается в популяции с высокой частотой, и вероятность того, что родители будут гетерозиготны, достаточно высока. В Великобритании, где были проведены первые работы по изучению сцепления ABO-NPS, частоты аллелей 1А, 1В и 1O составляют примерно 0,66; 0,28 и 0,06 соответственно.
Термин «частота аллеля» обозначает долю конкретного аллеля среди всех аллелей данного локуса в популяции. Например, для двухаллельного локуса (A I, A2) в популяции из 13 000 человек, где 3800 человек имеют генотип А1А1, 6400 — А1А2 и2800 —А2Α2, частота аллеля A1 составляет
| Таблица 20.2. Суммарные значения Z при разных θ для локусов АВО и NPSI 1) |

|

|
Молекулярная генетика человека 451

|
| а частота аллеля А2 - |

|
Для большинства локусов частота одного аллеля (>0,999) значительно превышает частоту другого (других) (<0,001). Вследствие этого в больших популяциях подавляющее большинство (99,8%) особей оказываются гомозиготными по более часто встречающемуся аллелю, около 0,198% — гетерозиготными и 0,001% — гомозиготными по редкому аллелю. В подобных условиях практически невозможно установить сегрегацию аллелей данного локуса или его сцепление с другим локусом, поскольку большинство родителей будут гомозиготны по часто встречающемуся аллелю. Если же частоты двух аллелей данного локуса составляют 0,99 и 0,01, то гетерозиготными будут примерно 1% особей, и шансы обнаружить сегрегацию или сцепление возрастают, поскольку в популяции много особей, гетерозиготных по данному локусу (табл. 20.3). Таким образом, изучение сцепления у человека возможно только для локусов с часто встречающимися аллелями. Если два или больше аллелей данного локуса встречаются в популяции с частотой 0,01 и выше, то говорят, что имеет место генетический полиморфизм, и локус называют полиморфным. Поскольку генетический полиморфизм, подобный полиморфизму аллелей системы АВО, встречается редко, для осуществления проектов по картированию хромосом необходимо разрабатывать методы, которые позволяют с легкостью обнаруживать большое количество полиморфных сайтов.
| Таблица 20.3. Частоты аллелей и генотипов в большой популяции со случайным скрещиванием 1) | ||||
| Частоты аллелей A1 А2 | Частоты генотипов А1Α1 Α1Α2 | А2А2 | ||
| 1,0 | 1,0 | |||
| 0,999 | 0.001 | 0.998001 | 0,001998 | 0,000001 |
| 0,99 | 0,01 | 0.9801 | 0,0198 | 0.0001 |
| 0,90 | 0.10 | 0,81 | 0,18 | 0.01 |
| 0,75 | 0.25 | 0.5625 | 0,3750 | 0.0625 |
| 0,50 | 0,50 | 0,25 | 0,50 | 0,25 |
| 0,25 | 0,75 | 0,0625 | 0,3750 | 0,5625 |
| 0,10 | 0.90 | 0,01 | 0,18 | 0,81 |
| 0,01 | 0,99 | 0,0001 | 0,0198 | 0,9801 |
| 0,001 | 0,999 | 0,000001 | 0,001998 | 0,998001 |
| 1,0 | 1,0 | |||
| 1) Серым цветом указаны те частоты аллелей, при которых имеет места полиморфизм. |
Полиморфизм длины рестрикционных фрагментов
Для возникновения аллелей достаточно, чтобы два гомологичных гена различались всего одним нуклеотидом. Во многих случаях замена одного нуклеотида приводит к значительным различиям между продуктом измененного гена и нормальным белком. Однако множество однонуклеотидных замен не приводит к синтезу измененных генных продуктов, а кроме того, замены могут происходить в некодирующих областях ДНК и не приводить ни к каким последствиям. Такие «безвредные» замены, распределяясь по всей длине хромосомы, порождают полиморфные сайты (маркерные локусы, генетические маркеры), которые можно использовать для генетического картирования. Но сначала эти полиморфные сайты нужно обнаружить.
В 1980г. Д. Ботштейн, Р. Уайт, M Сколники В. Дэвис (D. Botstein, R.L. White, М.Н. Skolnick, R.W. Davis) разработали теоретические основы идентификации однонуклеотидных полиморфных сайтов и использования их в качестве маркеров для построения хромосомных карт человека. Смысл методологии состоит в следующем. Рестрицирующие эндонуклеазы (рестриктазы) расщепляют ДНК в специфических сайтах. Когда однонуклеотидная замена происходит внутри такого сайта, рестриктаза перестает его расщеплять, но по-прежнему узнает и расщепляет интактный сайт в другой хромосоме (рис. 20.11, А). Поскольку один из аллелей содержит сайт узнавания для данной рестриктазы, а другой — нет, то при обработке ДНК этой рестриктазой образуются фрагменты разной длины. Наличие или отсутствие полиморфного сайта рестрикции можно установить, проведя гибридизацию ДНК с зондом, строго специфичным в отношении уникального участка хромосомы.
452 ГЛАВА 20

| Рис. 20.11. Использование рестрикционных сайтов в качестве генетических маркеров. А. Замена одной пары нуклеотидов в рестрикционном сайте приводит к тому, что рестриктаза не распознает его и не расщепляет ДНК. Интактный и измененный сайты рестрикции отмечены знаками (+) и (— ) соответственно. Б. Участок одной хромосомы, содержащий три сайта (А. 1 и В), узнаваемые одной и той же рестриктазой. X — расстояние между сайтами А и 1, Y — расстояние между сайтами 1 и В, X + Y -расстояние между сайтами А и В. Сайты А и В во всех случаях интактны (оба +), а сайт 1 может быть как интактным (+), так и измененным (-). Если сайт I интактен (+), то после обработки ДНК рестриктазой образуются фрагменты X и Y. Если же он изменен (— ), то образуется единственный фрагмент (X + Y). Если провести блот-гибридизацию по Саузерну с зондом α, то мы обнаружим фрагмент X в том случае, если сайт 1 интактен (+), и фрагмент (X + Y), если он изменен (— ). В. Фрагменты, образующиеся после обработки рестриктазой, и фрагменты, выявляемые при гибридизации по Саузерну с зондом а, для каждого из генотипов (+/+, +/-, — /— ). Г. Фрагменты одной хромосомы, образующиеся после обработки рестриктазой, и фрагменты, выявляемые при гибридизации с зондом β или γ. |
Молекулярная генетика человека 453
Предполжим, например, что какой-то участок хромосомы содержит три сайта, распознаваемых рестриктазой HindIII (рис. 20.11, Б), при этом у всех индивидуумов сайты А и В интактны. Это означает, что в популяции нет альтернативных аллелей по этим сайтам, т. е. отсутствует полиморфизм. В отличие от этого в сайте 1 с высокой частотой встречается однонуклеотидная замена, в результате чего он становится устойчивым к расщеплению HindIII. Таким образом, две хромосомы в популяции различаются по данному сайту: одна из них расщепляется (+), а другая нет (-).
Если расстояния от сайта А до сайта 1 и от сайта ) до сайта В не совпадают, каждое из них не превышает 20 т. п, н. и существует однокопийный зонд, гибридизующийся с участком ДНК между сайтами А и 1 (рис. 20.11, Е), то после блот-гибридизации по Саузерну и разделения в агарозном геле фрагментов ДНК, полученных в результате обработки HindIII, мы сможем различить две ситуации. Первая — сайт 1 расщепляется, в результате чего образуется два фрагмента, и зонд гибридизуется с тем из них, который ограничивается сайтами А и 1. Вторая — сайт 1 не расщепляется и зонд гибридизуется с фрагментом ДНК, ограниченным сайтами А и В (рис. 20.11, Б).
Анализ реальных образцов ДНК несколько более сложен, поскольку хромосомы встречаются парами (рис. 20.11, В). Однако и в этом случае каждому генотипу (+/+, +/—, —/—) соответствует определенный набор фрагментов, образующийся в результате гибридизации с зондом. Кроме того, для выявления сайта рестрикции на участке I можно использовать зонды, гибридизующиеся с другими участками ДНК между сайтами А и В (рис. 20.11, Г). Феномен, состоящий в том, что наличие часто встречающегося в популяции измененного рестрикционного сайта приводит к образованию специфического набора фрагментов ДНК, называют полиморфизмом длины рестрикционных фрагментов (ПДРФ). Полиморфные сайты рестрикции образуют маркерные локусы на той хромосоме, где они присутствуют.
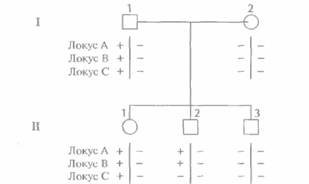
Генетический статус каждого ПДРФ-локуса на одной хромосоме называют гаплотипом. В случае одного сайта существуют два возможных гаплотипа (+ или —), в случае двух разных сайтов — четыре (++, + —, —+, – –); для n локусов число гаплотипов равно 2". Определение аллелей ПДРФ-локуса (или любых других полиморфных локусов), присутствующих на хромосомах данного индивидуума, называется гаплотипированием (генотипированием, ДНК-тип ированием). Наследование ПДРФ-локусов происходит в соответствии с законами Менделя, и можно проследить их передачу в пределах родословной. Если изучается наследование двух и более ПДРФ-локусов в данной семье, то можно выявить рекомбинацию. На рис. 20.12 представлена следующая ситуация: отец (1-1) гетерозиготен по трем разным ПДРФ-локусам, расположенным на одной хромосоме, а у матери (1-2) сайты рестрикции в трех рассматриваемых локу-сах отсутствуют. Генетический статус хромосомы, унаследованной от отца каждым из детей, можно установить путем генотипирования. Сын П-2 получил от отца хромосому, в которой произошел кроссинговер; остальные дети унаследовали от него нерекомбинантные хромосомы.
На практике ДНК каждого индивидуума в отдельной пробирке обрабатывают различными
|
| Рис. 20.12, Выявление сегрегации и рекомбинации ПДРФ-локусов в родословной. Знаками плюс (+) и минус (— ) обозначены аллели, содержащие интактные и измененные сайты рестрикции, трех ПД РФ- локусов (А, В, С), расположенных на одной хромосоме. Генетический статус I-1 определен исходя из генотипов его родителей, +++/+++ и --- / --- (не показаны). Определение гаплотипов у детей показывает, что II-2 получил от 1-1 рекомбинантнуто хромосому, а П-1 и II-3 — нерекомбинантные. Вертикальная черта, разделяющая наборы ПДРФ-аллелей под символом, обозначающим каждого члена семьи, разделяет гомологичные хромосомы. |
454 ГЛАВА 20
рестриктазами, а затем гибридизуют с клонированными однокопийными фрагментами ДНК, которые используются в качестве зондов для выявления ПДРФ. Гибридизация ДНК-зонда с препаратом метафазных хромосом человека, распластанных на предметном стекле (гибридизация in situ), позволяет определить, соответствует ли данный зонд уникальному участку хромосомы (однокопийной ДНК). Для обозначения тысяч ПДРФ-локусов разработана стандартная номенклатура. Например, запись D21S18 соответствует локусу, идентифицированному с помощью ДНК-зонда (D), который гибридизуется с хромосомой 21 (21), представлен одной копией (S) и зарегистрирован Комитетом по систематизации карт сцепления человека (DNA Committee of the International System for Human Linkage Maps -ISLM) под восемнадцатым номером (18). Полиморфные маркерные сайты, расположенные внутри известных генов, обозначают по названию гена. Например, ADH — это полиморфный локус в гене алкогольдегидрогеназы (ADH1). Никакого стандартного обозначения для ПДРФ-аллелей не существует. В одних лабораториях аллели нумеруют по порядку (DlS34*l, D1S43*2 и т. д.), в других — по длине фрагмента (в т.п.н.), образующегося при наличии или в отсутствие сайта (сайтов) рестрикции (D4S56*8, D4S56*12, D4S564 и т. д.).
Уже идентифицированы тысячи ПДРФ-локусов, благодаря чему значительно увеличилось число аллелей, которые можно использовать для генетических исследований. Сцепление между ПДРФ-локусом (локуса-ми) и геном того или иного заболевания можно установить, подсчитав «парный» («двухлокусный») лод-балл для гаплотипированных семей, в которых выявлены случаи изучаемого генетического заболевания. Аналогично, сцепление между ПДРФ-локусами можно обнаружить, проанализировав данные по родословным, представленным несколькими поколениями. Использование
ПДРФ для картирования имеет несколько ограничений. Эти локусы распределены по хромосомам неравномерно, зонды в виде клонов поддерживать неудобно, а гаплотипирование большого числа индивидов из нескольких семей методом блот-гибридизации по Саузерну весьма трудоемко. К счастью, в геноме человека в большом количестве (>100 000) встречаются другие полиморфные локусы, содержащие простые повторяющиеся элементы из двух, трех или четырех пар нуклеотидов — короткие тандемные повторы (STR, от англ. short tandem repeats), которые легко регистрируются с помощью полимеразной цепной реакции (ПЦР).
Полиморфизм коротких тандемных повторов
По геному человека равномерно распределены примерно 100 000 блоков динуклеотидных повторов CA/GT [(СА) · (GТ)] (рис. 20.13), содержащих от 1 до 40 повторяющихся CA/GT-элементов. Любой такой блок, локализованный в определенном участке хромосомы, передается из поколения в поколение с сохранением числа повторяющихся элементов. Для CA/GT-повтора принято обозначение (СА)n, где n — число СА-повторов. В геноме человека встречаются и другие динуклеотидные повторы [например, (АТ)n и т. д.], а также три-[(АТО)n и т. д.] и тетрануклеотидные [(ATCG)n и т. д.].
Чтобы идентифицировать полиморфные STR-локусы, нужно прежде всего провести скрининг геномной библиотеки человека, содержащей вставки небольшого размера (примерно 1000 п. н.), используя подходящий олиго-нуклеотидный зонд. Для идентификации клонированных (СА)n-повторов обычно используют зонд, состоящий из 15 СА-элементов. Каждую позитивную вставку секвенируют, чтобы установить длину СА-повтора и нуклеотидные последовательности фланкирующих его участков. Чтобы определить, являются ли фланкирующие последовательности однокопийны-

|
| Рис. 20. 13. Динуклеотидный тандемный повтор (СА)24, содержащий 24 повторяющихся элемента. |
Молекулярная генетика человека 455
| Рис. 20.14. Типирование STR-локусов, А. ДНК, полученную от разных индивидов (n = 7), амплифицировали с помощью ПЦР, используя пару праймеров (X), фланкирующих (СА)-(GТ)-повтор. Размер всех образовавшихся ПЦР-продуктов одинаков (дорожки 1—7), следовательно, одинакова и длина STR. Судя по полученным данным, STR-локус представлен только одним аллелем, Б. То же, что и на рис. А, но с использованием другой пары праймеров (Y) для другого STR-локуса. Образование двух разных ΠЦР-продуктов означает, что данный локус представлен двумя аллелями. Дорожки 1—3 соответствуют амплифииированному фрагменту ДНК индивидов, гомозиготных по одному STR-аллелю, дорожки 4 и 5 — амплифицированному фрагменту ДНК гетерозиготных индивидов, несущих два разных STR-аллеля, дорожки 6 и 7 — амплифииированному фрагменту ДНК индивидов, гомозиготных по другому STR-аллелю. | 
|
ми, проводят гибридизацию in situ с комплементарными им зондами, и если обнаруживается, что эти последовательности встречаются в геноме один раз, то синтезируют пару комплементарных им праймеров и проводят амплификацию СА-повтора. Далее, используя эту пару праймеров, проводят ПЦР-тестирование ДНК, полученной от большого числа индивидуумов. ΠЦР-продукты, длина которых для удобства электрофоретического разделения выбирается примерно 200 п. н., разделяют в полиакриламидном геле. Если длина амплифицированного таким образом сегмента ДНК одинакова для всех образцов ДНК, значит, повтор не полиморфен (рис. 20.14, А), и наоборот, если образуются
ΠЦР-продукты разной длины, это указывает на полиморфизм по данному STR (STR-полиморфизм, STRP) (рис. 20.14, Б). Различающиеся по длине СА-повторы данного локуса представляют собой аллели (рис. 20.15). Такие аллели нередко встречаются с частотой 0,20 и даже больше.
К настоящему времени уже обнаружены тысячи STRP-локусов. Для их обозначения используются те же правила, что и для ПДРФ-локусов. В то же время названия STRP-праймеров часто отличаются от названий локусов. Многие STRP-локусы были идентифицированы французскими исследователями при финансовой поддержке со стороны Французской ассоциации по мышечным дистрофиям (Association Française contre les
| Рис. 20.15. Два STR-аллеля. Один из них (аллель 1) содержит повтор (CA)15 другой (аллель 2) — (СА)10. Повторы в обоих случаях фланкированы одинаковыми уникальными последовател ьностя м и . | 
|
456 ГЛАВА 20
Myopathies), и это нашло свое отражение в том, что обозначения многих пар STRP-праймеров начинаются с аббревиатуры АРМ, после которой идет идентификационный номер (AFM349xc5). Обозначение пары праймеров часто сопровождается обозначением соответствующего локуса [AFM349xc5 (D3S2017)].
В настоящее время для картирования генома человека используются в основном не ПДРФ-локусы, a STRP. В отличие от ПДРФ-зондов, которые необходимо клонировать в векторе, очищать и метить, в случае STRP-локусов нужна информация лишь о нуклеотидной последовательности пары праймеров, которая может храниться в компьютерной базе данных. Кроме того, STRP-локусы равномерно распределены в геноме человека; частоты STR-аллелей очень высоки, что обеспечивает высокую гетерозиготность, а сами аллели без труда идентифицируются после ПЦР-амплификации.
Картирование локуса генетического заболевания в определенном районе хромосомы
Анализ родословных не позволяет установить хромосомную локализацию гена того или иного заболевания, если только этот ген не находится на Х-хромосоме. Однако можно исследовать сцепление между геном данного заболевания и полиморфными ПДРФ- или STRP-локусами, идентифицируя последние с помошью соответствующих зондов. Этот подход дает наилучший результат в том случае, когда заболевание имеет четкие симптомы, его наследование носит однозначный характер и известна степень его пенетрантности.
Для анализа сцепления прежде всего берут пробы крови у членов нескольких семей, представленных двумя-тремя поколениями, либо у членов одной большой семьи, представленной несколькими поколениями, с данным генетическим заболеванием (при этом необходимо проинформировать всех испытуемых о целях анализа и получить их согласие). Клетки крови культивируют, что позволяет постоянно получать ДНК для дальнейших процедур без повторного забора крови. Проводят генотипирование ДНК каждого индивида по нескольким полиморфным маркерам. В некоторых исследованиях используют более 250 маркеров, представляющих разные участки всех аутосом. Для всех информативных семей для каждого полиморфного локуса и локуса генетического заболевания вычисляют двухточечный (двухлокусный) лод-балл. Если Z> +3,00, то имеет место сцепление, при Z< —2,00 сцепление исключается.
Дата добавления: 2015-07-14; просмотров: 687;
