E. M. Donaldson, P.Swanson, W.-K. Chan. 5 страница
Улавливание экзонов («поимка» экзонов, экзонная амплификация) — это метод, позволяющий идентифицировать и клонировать экзоны, находящиеся в субклонах, полученных из геномных клонов (рис. 20.29), Его суть состоит в
|
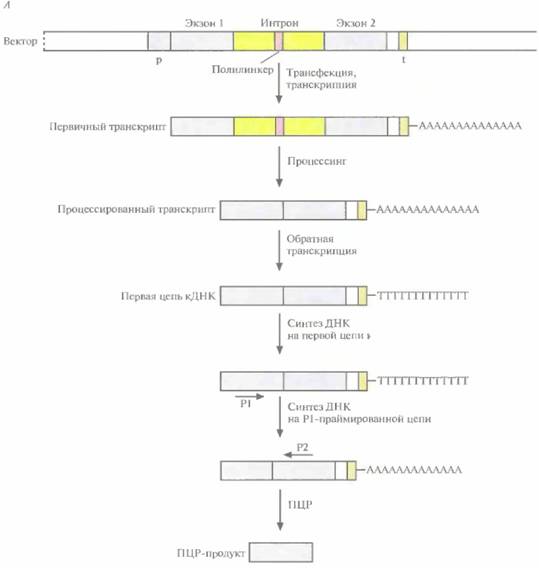
| Рис. 20.29. Улавливание экзонов. А. Вектор для улавливания экзонов содержит искусственный ген, состоящий из промотора р, двух экзонов, разделенных интроном, который несет полилинкер, и сайта терминации транскрипции t. После введения вектора в эукариотическую клетку искусственный ген транскрибируется и из первичного транскрипта удаляется интрон. Для получения ΠЦР-продукта определенной длины, который содержит часть обоих экзонов, используют ПЦР-амплификацию обратного транскрипта. |
Молекулярная генетика человека 475
следующем. ДНК геномного клона расщепляют так, чтобы получить фрагменты длиной 1-6 т. п. н., и клонируют эти фрагменты в специально сконструированном векторе. Сайт множественного клонирования (полилинкер) вектора расположен внутри интрона, фланкированного двумя экзонами (экзон I и экзон 2). Этот искусственный ген (экзон 1—интрон—экзон 2) находится под контролем сильного эукариотического промотора и может реплицироваться в Е. coli или в культуре клеток млекопитающих. После введения (трансфекции) вектора без вставки в клетку млекопитающего происходит транскрипция искусственного гена и удаление интрона из пер-
|
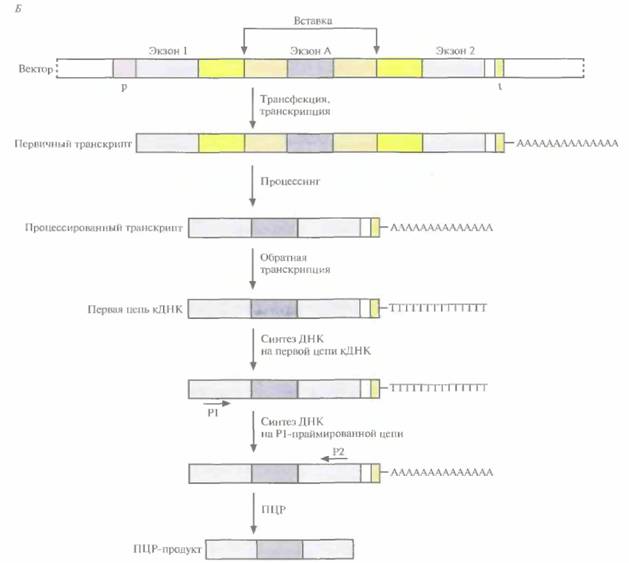
| Рис. 20.29. (Продолжение) Б. В полилинкер вектора для улавливания экзонов встроен фрагмент ДНК человека, и эта конструкция введена в эукариотическую клетку (трансфекция). В данном случае экзон содержит функциональные акцепторный и донорный сайты сплайсинга. При процессинге первичного транскрипта удаляются интроны, фланкирующие экзон А, и он оказывается между экзонами 1 и 2, Длина ПЦР-продукта обратного транскрипта показывает, «пойман" ли искомый экзон между экзонами 1 и 2 и, следовательно, содержит ли его данная вставка. |
476 ГЛАВА 20
винного транскрипта. Процессированную РНК (экзон 1 —экзон 2) можно выявить, проведя ΠЦР-амплификацию обратного транскрипта. Сначала с помощью обратной транскриптазы на мРНК синтезируют ДНК (синтез первой цепи). Вторую цепь синтезируют при участии праймера, комплементарного части экзона 1 первой цепи. Затем в реакционную смесь добавляют второй праймер, комплементарный части экзона 2 второй цепи ДНК, и проводят ПЦР-амплификацию. Длину ПЦР-продукта определяют с помощью гель-электрофореза.
Если в вектор встроить рестрикционный фрагмент, содержащий некий экзон А и фланкирующие его интроны, то после трансфекции процессированный транскрипт будет содержать три экзона: экзон 1—экзон А—экзон 2, Длина ПЦР-продукта будет больше, чем в тех случаях, когда в векторе нет вставки, когда вставка содержит экзон без функциональных сайтов сплайсинга (донорного и акцепторного) или когда вставка вообще не содержит экзона. Если во вставке присутствует более одного экзона, каждый из которых имеет функциональные сайты сплайсинга, то процессированный транскрипт будет содержать все эти экзоны.
В том случае, если в каждом праймере содержатся рестрикционные сайты, клонируют ПЦР-продукт, несущий «пойманный» экзон, и используют последний в качестве зонда для скрининга кДНК-библиотеки. Зная нуклеотидную последовательность «пойманного» экзона, предпринимают поиск гомологичных ему последовательностей в базе данных. Если есть основания полагать, что «пойманный» экзон с большой вероятностью является частью гена данного заболевания, то характеризуют и секвенируют геномные клоны, охватывающие место расположения данного гена, и исследуют образцы ДНК больных и здоровых индивидов с целью выявления мутаций. Поскольку мутации, ответственные за патологию, не всегда бывают равномерно распределены по всем экзонам, чем больше размер сканированной кодирующей области предполагаемого гена, тем больше вероятность обнаружения мутации.
Для идентификации экзонов используют различные компьютерные программы, например GRAIL (Gene Recognition and Analysis Internet Line). Они созданы исходя из некоторых характерных для экзона особенностей. Одна из них — ожидаемая нуклеотидная последовательность кодирующей области. Если лаборатория оснащена оборудованием для широкомасштабного секвенирования, можно секвенировать геномные клоны, охватывающие область расположения искомого гена, и провести компьютерную обработку полученных данных с целью выявления экзонов. Нуклеотидную последовательность предполагаемого экзона можно использовать для поиска гомологичных ей последовательностей в генной базе данных или синтезировать на ее основе олигонуклеотидный зонд для скрининга кДНК-библиотеки, Наконец, как и в случае других методов идентификации экзонов в геномных клонах, необходимо доказать, что предполагаемый экзон является частью гена-мишени.
Реализация любого проекта по позиционному картированию гена занимает много времени. За период с 1986 по 1995 г, с помощью данного подхода удалось обнаружить более 50 генов различных заболеваний человека, что можно считать большим достижением. Иногда поиск гена занимает 1—2 года, в то же время для обнаружения гена хореи Гентингтона консорциуму из нескольких исследовательских лабораторий потребовалось 10 лет. Отметим, что с клонированием все новых и новых генов и построением транскрипционных карт с высоким разрешением позиционное картирование постепенно уступает место позиционно-кандидатному.
Позиционно-кандидатное картирование
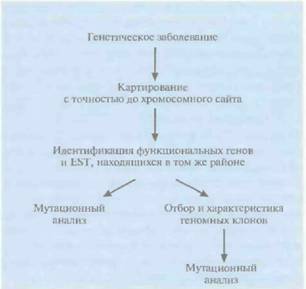
Позиционно-кандидатное картирование состоит в определении хромосомной локализации гена болезни, продукт которого неизвестен, и последующем анализе современных генетических и транскрипционных карт, с тем чтобы выявить кодирующие последовательности (гены, внутригенные EST), находящиеся в этом же районе (рис. 20.30). Весьма вероятно, что одна из этих последовательностей и окажется геном данного заболевания. Если какой-либо из генов-кандидатов охарактеризован, можно провести его мутационный анализ. Как альтернативу можно использовать «кандидатные» EST в качестве зондов, отобрать с их помощью геномный клон и секвенировать его, а затем также провести му-
Молекулярнаягенетика человека 477
|
| Рис. 20.30. Позиционно-кандидатное картирование. Идентификация гена заболевания в том случае, когда продукт гена неизвестен, но ген картирован в том же хромосомном районе, что и некоторые функиионалъные гены и EST. Из этих генов и EST отбирают "кандидатные» и определяют, какие из них соответствуют искомому гену. |
тационный анализ. По мере детализации физических и транскрипционных карт позиционно-кандидатное картирование становится все более популярным при поиске генов различных заболеваний человека.
Программа «Геном человека»
Работа над реализацией программы «Геном человека» (HGP, Human Genome Project) официально началась 1 октября 1990 г. в США и контролирует ее Министерство энергетики (Department of Energy) совместно с Государственными институтами здоровья (National Institutes of Health) США. Ее конечная цель состоит в определении нуклеотидной последовательности всего генома человека. Полученная обширная генетическая информация станет основой для более узких проектов исследования всех моногенных генетических заболеваний и послужит трамплином для изучения сложных наследственных патологий. В 1990 г. предполагалось, что работа в рамках HGP займет 15 лет, а ее стоимость составит
2 млрд. долл. За короткое время программа стала международной, ее проекты финансируются правительствами Великобритании, Франции. Канады, Германии и Японии. В настоящее время происходит кооперация и координация усилий многих государственных и межгосударственных агентств, частных компаний и некоммерческих исследовательских институтов. HGP - обширная программа, охватывающая множество различных направлений.
Та часть программы «Геном человека», которая выполняется в США, включает следующие подпрограммы: построение генетических и физических карт с высоким разрешением; снижение себестоимости и повышение эффективности крупномасштабного секвенирования ДНК; разработка новых технологий картирования генов и секвенирования ДНК; усовершенствование компьютерных технологий для обработки и хранения больших массивов данных; изучение этического, правового и социального аспектов исследований, проводимых в рамках программы. Цель последней подпрограммы состоит в создани руководств для исследователей и врачей и обосновании политики правительства, касающейся использования генетической информации. В рамках подпрограммы «Новые технологии" консорциумом нескольких групп исследователей был полностью секвенирован геном дрожжей Saccharomyces cerevisiae (150 т. п. н.). Кроме того, определены полные пуклеотидные последовательности ДНК других «модельных» организмов, таких как нематоды (Caenorhabditis elegans, 100 м. п. н.), плодовая мушка (Drosophila melanogaster, 120 м. п. н.), бактерии (Е. coli. 4,2 т. п. н.), мышь (Mus musculus, 3000 м. п. н.).
Некоторые из намеченных на период 1990—1995 гг. задач той части HGP, которая выполняется в США, в 1993 г. были пересмотрены; это связано с быстрым прогрессом в генетическом картировании благодаря внедрению микросателлитных полиморфных маркеров и построению практически полных физических карт. К 1996 г. удалось решить несколько вновь поставленных задач. Например, в 1994 г. была опубликована карта (генетического) сцепления человека, которая содержала 5826 локусов, охватывающих 4000 сМ, Хотя только для 908 локусов шансы сцепления составили больше 1000:1, ко-
Дата добавления: 2015-07-14; просмотров: 1301;
