ГЛАВА 21
| Таблица 21.1. Применяемые в настоящее время методы лечения некоторых моногенных заболеваний человека | ||||
| Генный продукт | Заболевание и его симптомы | Частота встречаемости | Лечение | Прогноз |
| Аденозиндезаминаза | Тяжелый комбинированный иммунодефицит (SCID) Утрата Т- и В-лимфоцитов | 1:1 000000 | Трансплантация костного мозга; введение аденозиндезaминазы | Без лечения: летальный исход к двум годам С лечением: улучшение состояния пациента |
| Рецептор липопротеинов низкой плотности | Семейная гиперхолестеролемия Повышенный уровень холестерола в крови, ишемическая болезнь сердца | 1:500 (гетерозиготы) | Диета, медикаментозное лечение трансплантация печени | Улучшение состояния пациента |
| Глюкоцереброзидаза | Болезнь Гоше Накопление гл юкоиереброзидов в макрофагах, приводящее к поражению печени, селезенки и костей | 1:2 500 (среди евреев); редко у неевреев | Симптоматическое лечение: удаление селезенки, введение антибиотиков, лечение поражений костей, трансплантация костного мозга, введение глюкоцереброзидазы | Улучшение состояния пациента |
| Фактор VIII системы свертывания крови | Гемофилия Λ Изменение фактора VIII, приводившее к нарушению свертываемости крови, хронические кровоизлияния в суставы; обширные кровотечения при травмах | 1:10000 (у мужчин) | Повышение концентрации фактора VIII с помошью переливания плазмы | Увеличение продолжительности жизни при постоянном лечении; при переливании есть риск вирусной инфекции |
| Фенилаланин-гидроксилаза | Фенилкетонурия Избыток фенилаланина в крови новорожденных, умственная отсталость | 1: 10000 | Диета, исключающая фенилаланин | При ранней диагностике и непрерывном лечении — обычно благоприятный |
| α1 - Антитрипсин | Эмфизема Дефицит ингибитора сывороточных протеаз, поражение легких, цирроз печени | 1:3500 | Заместительная терапия; снижение экологических факторов риска | Заболевание прогрессирует медленнее |
ванного иммунодефицита (SCID, от англ, severe combined immunodeficiency) и болезни Гоше. Иногда для компенсации каких-то утраченных функций проводят трансплантацию костного мозга или других органов. К сожалению, нередко интенсивное лечение многих наследственных болезней начинают проводить только тогда, когда пациент находится в критическом состоянии и удается лишь ненамного продлить его жизнь. Поскольку генетические заболевания часто носят системный характер и постепенно приводят к ослаблению организма, разработка эффективных методов лечения представляет собой непростую задачу. Существующая терапия, как правило, малоэффективна, лишь немногие пациенты доживают до старости и могут иметь детей. В большинстве случаев лечение необходимо проводить многократно, оно очень дорогое и длительное. Поэтому разработка новых видов терапии очень актуальна.
После того как были установлены молекулярные основы трансформации бактерий (переноса генов из одного штамма в другой), у ученых появилась надежда, что аналогичный механизм — введение нормальных генов в дефектные соматические клетки — можно будет использовать для лечения наследственных заболеваний человека. Перспективы генной коррекции соматических клеток стали более реальными в 1980-х гг.; к этому времени были
Генная терапия 485
| Таблица 21.1. (Продолжение) | ||||
| Генный продукт | Заболевание и его симптомы | Частота встречаемости | Лечение | Прогноз |
| Трансмембранный белок, нарушения в котором приводят к муковисцидозу | Myковисцидоз Системное поражение органов, в ряде случаев недостаточность поджелудочной железы, закупорка кишечника, закупорка бронхов | 1:2500 (европеоиды) | Введение антибиотиков, физикальная очистка легких, общеукрепляющая диета | Летальный исход в возрасте до 20 лет |
| Орнитин- транскарбамилаза | Гипераммониемия Нарушение цикла мочевины, накопление аммония, дефицит аргинина Ранняя форма, развивающаяся в первые 72 ч после рождения: летаргия, рвота, кома, смерть; в случае выживания — необратимое повреждение мозга Поздняя форма; рвота, летаргия, эпилептические припадки | 1:40 000 | Диета с ограничением белка, диета, обогащенная аргинином, лекарственные Средства, трансплантация печени | Поздняя форма; благоприятный Ранняя (тяжелая) форма: снижение тяжести симптомов |
| Дистрофин | Мышечная дистрофия Дюшенна Πрогрессирующая слабость мышц | 1:7 500 (у мужчин) | Только поддерживающее лечение; полноценное питание, помощь в функционировании дыхательной системы, передвижение в инвалидной коляске | Летальный исход к 20 годам |
| β-Глобин | Серповидноклеточная анемия Хроническая анемия, системное поражение органов, селезенки, сердца, почек, печени, мозга; у гетерозиготных носителей наблюдается мягкая форма болезни | 1:500 (для гетерозигот в популяциях афроамериканцев ; в других популяциях — реже) | Переливание крови, медикаментозная терапия, анальгетики, трансплантация костного мозга | Снижение тяжести симптомов; эффективное лечение отсутствует |
разработаны методы получения изолированных генов, созданы эукариотические экспрессирующие векторы, стали рутинными эксперименты по переносу генов на мышах. В 1990 г. была предпринята первая попытка применения генотерапии для лечения SC1D (табл. 21.1) у двух девочек. Использовался следующий подход. Клонированную кДНК аденозиндезаминазы (АДА) ввели в лимфоциты, полученные от каждой из пациенток. Модифицированные клетки, синтезирующие АДА, культивировали и в течение двух лет с определенной периодичностью вводили девочкам. Через четыре года после начала лечения у обеих пациенток наблюдалась экспрессия гена АДА и отмечалось облегчение симптомов SCID. Однако истинная причина улучшения осталась не совсем ясной: был ли это эффект заместительной терапии (внутривенного введения защищенной формы АДА - полиэтиленгликоль-АДА) или собственно генной терапии. Беспорно одно: этот опыт показал безопасность генной терапии. Сходные результаты были получены и для других пациентов с SCID, одновременно получавших оба вида лечения. Исследования были продолжены на большем числе больных.
В соответствии с законодательством США, прежде чем новый лекарственный препарат будет разрешен к применению, он должен пройти четыре строго оговоренных стадии проверки.
486 ГЛАВА 21
1. Доклинические испытания, которые включают многочисленные эксперименты, проводимые in vitro и на лабораторных животных.
2. I фаза клинических испытаний проводится на небольшом числе (от 6 до 10) пациентов и часто имеет целью проверку безопасности препарата.
3. II фаза клинических испытаний проводится на большем числе пациентов и имеет целью проверку эффективности действия препарата.
4. III фаза клинических испытаний проводится с привлечением большого числа испытуемых и включает исчерпывающий анализ надежности и эффективности препарата, при этом используется информация, полученная на предыдущих этапах.
Прежде чем начать проверку препарата, необходимо, чтобы протокол его испытаний был одобрен и утвержден в соответствующих контролирующих инстанциях. С 1990 по 1992 г. было одобрено более десяти протоколов испытаний по генной терапии, находящихся в I фазе, а к 1997 г. — более 200 протоколов испытаний по генной терапии разных видов злокачественных новообразований, гемофилии, СПИДа, муковисцидоза, гиперхолестеролемии, бокового амиотрофического склероза и др. (табл. 21.2). Прежде чем приступать к I фазе клинических испытаний, необходимо учесть ряд важных моментов: предполагаемое исследование должно быть направлено на разработку методов лечения однозначно диагностируемой болезни, соответствовать существующим правилам проведения медико-биологических экспериментов и осуществляться с минимальным для пациента риском. Поскольку генная терапия представляет собой новое направление, а заболевания, которые предполагают лечить с ее помощью, столь различны, рассматривают множество разных подходов. В настоящее время все исследования по генной терапии направлены на коррекцию генетических дефектов соматических, а не половых (зародышевых) клеток. Это объясняется этическими и чисто техническими причинами, а так-
| Таблица 21.2. Некоторые заболевания, генная терапия которых проходит испытания с 1990 г. | ||
| Заболевание | Генотерапевтический препарат | Клетки-мишени |
| Тяжелый комбинированный иммунодефицит | Аденозиндезаминаза | Лимфоциты, клетки костного мозга |
| Меланома | Фактор некроза опухоли | Инфильтрирующие опухоль лимфоциты, аутологичные клетки опухоли |
| Меланома, глиобластома, рак почки | Интерлейкин-2 | Аутологичные клетки опухоли, клетки опухоли |
| Гемофилия В | Фактор IX | Аутологичные фибробласты кожи |
| Гигтерхолестеролемия | Рецептор липопротеинов низкой плотности | Аутологичные гепатоциты |
| Меланома, рак толстой и прямой кишки, рак почки | Антиген гистосовместимости HLA-B7 u β2- микроглобулин | Клетки опухоли |
| Глиобластома, СПИД, рак яичников | Тимидинкиназа вируса простого герпеса | Клетки опухоли, Т-лимфоциты |
| Муковисцидоз | Трансмембранный белок, нарушения в котором приводят к муковисцидоэу | Эпителий носовой полости и дыхательных путей |
| Рак молочной железы | Фактор типа 1 множественной устойчивости к лекарственным препаратам | CD34+- клетки крови |
| Меланома | Гранулоцитарный колониестимупируюший фактор | Клетки опухоли |
| Артрит | Антагонист рецептора интерлейкина-1 | Аутологичные фибробласты |
| Боковой амиотрофический склероз | Цилиарный нейротрофический фактор (CNTF) человека | Инкапсулированные трансдуцированные экзогенные клетки |
| Плоскоклеточный рак головы и шеи | p53 | Клетки опухоли |
| Анемия Фанкони | Фактор анемии Фанкони группы С | Клетки головного мозга |
Генная терапия 487
же соображениями безопасности: ведь ДНК, введенная в половые клетки человека, передавалась бы последующим поколениям.
В самом общем смысле под генной терапией соматических клеток человека понимают коррекцию специфического наследственного заболевания путем введения в клетку-мишень функционального экспрессирующегося гена. Однако за этим простым определением скрывается целый ряд проблем. Например, как получить доступ к клеткам, предназначенным для коррекции? Как осуществить доставку терапевтического гена? Какая доля клеток-мишеней должна получить такой ген, чтобы болезнь отступила? Необходим ли точный контроль транскрипции введенного гена для обеспечения ее эффективности? Не вызовет ли избыточная экспрессия введенного гена побочных эффектов? Будут ли модифицированные клетки поддерживаться бесконечно или потребуются повторные введения?
Хотя генная терапия соматических клеток делает только свои первые шаги, на ряд вопросов, касающихся некоторых наследственных заболеваний, уже получены ответы. Появляются все новые подходы к генной терапии соматических клеток, которые можно разделить на две большие категории: генная терапия in vivo и ex
| Рис. 21.1. Схематическое представление генной терапии ex vivo. Процедура включает: 1) получение от пациента клеток с генным дефектом; 2) культивирование изолированных клеток; 3) трансфекцию «терапевтической» генной конструкции в изолированные клетки; 4) отбор, выращивание и тестирование трансфицированных клеток; 5) трансплантацию или трансфузию трансфицированных клеток пациенту. | 
|
vivo. Разрабатывают и специфические лекарственные препараты на основе нуклеиновых кислот: антисмысловые олигонуклеотиды; РНК-ферменты, модифицированные с помощью генной инженерии; олигонуклеотиды, корректирующие генные мутации in vivo.
Генная терапия ex vivo
Генная терапия ex vivo, как правило, включает следующие этапы (рис. 21.1).
1. Получение клеток от больного.
2. Исправление генетического дефекта с помощью переноса нужного гена в изолированные клетки.
3. Отбор и наращивание генетически «исправленных» клеток.
4. Инфузия или трансплантация этих клеток пациенту.
Использование собственных клеток пациента (аутологичных клеток) гарантирует, что после инфузии или трансплантации у него не разовьется иммунный ответ.
Необходимо, чтобы процедура переноса генов, используемая для генной терапии ex vivo,
488ГЛАВА 2]
была эффективной, а «терапевтический» ген стабильно поддерживался и непрерывно экспрессировался. Этим условиям отвечают векторы, полученные на основе мышиных ретровирусов. Но ретровирусы имеют существенный недостаток — они могут приводить к злокачественной транформации клеток. Такую вероятность необходимо уменьшить, а лучше полностью исключить.
Геном ретровируса дикого типа представлен двумя идентичными одноцепочечными молекулами РНК, каждая из которых состоит из шести участков: длинного концевого повтора (5'-LTR, от англ, long terminal repeat); некодирующей последовательности пси+ (ψ+), необходимой для упаковки РНК в вирусную частицу; трех генов, кодирующих структурный белок внутреннего капсида (gag), белок, обладающий функциями обратной транскриптазы и интегразы (pol), и белок оболочки (env); 3'-LTR-последовательности (рис. 21.2). Жизненный цикл ретровируса включает следующие стадии.
1. Инфицирование клетки-мишени.
2. Синтез ДНК-копии генома с помощью собственной обратной транскриптазы,
3. Транспорт вирусной ДНК в ядро.
4. Встраивание вирусной ДНК в один из хромосомных сайтов клетки-хозяина.
5. Транскрипцию мРНК с вирусной ДНК под контролем сильного промотора, локализованного в 5'-LTR.
6. Трансляцию белков Gag, Pol и Env в цитоплазме.
7. Образование вирусного капсида и упаковку в него двух РНК-цепей и молекул обратной транскриптазы.
8. Высвобождение вирионов из клетки.
Для получения ретровирусного вектора полноразмерную ДНК ретровируса встраивают в плазмиду, с помощью эндонуклеазного расщепления удаляют большую часть гена gag и гены pol и env, оставляя 5'-концевой участок гена gag и 5'- и 3’-LTR, а затем рядом с ψ+-областью встраивают «терапевтический» ген, транскрипция которого будет контролироваться 5'-LTR-промо-тором; при необходимости можно встроить и маркерный селективный ген с собственным промотором (рис. 21.3). Такая конструкция позволяет экспрессировать оба клонированных гена. На основе этой схемы созданы различные ретровирусные векторы. Максимальный размер ДНК-вставки, которую может переносить ретровирусный вектор, — примерно 8 т. п. н.
ДНК ретровирусного вектора можно использовать для трансформации клеток саму по себе, но эффективность доставки ее в ядро и интеграции в геном клетки-хозяина крайне низка. Поэ-

| |
| Рис. 21.2. Генетическая карта типичного ретровируса. ψ+ — последовательность, ответственная за упаковку, gag, pol и env — области, кодирующие соответственно белок капсида, белок, обладающий активностью обратной транскриптазы и интегразы, и белок оболочки. 5'-LTR содержит сигналы инициации транскрипции, причем весь геном транскрибируется как одна молекула РНК. 3'-LTR содержит сигнал полиаденилирования. | |

| |
| Рис. 21.3. Генетическая карта ретровирусного вектора, несущего два гена. Транскрипция «терапевтического» гена (Ген X) контролируется 5'-LTR-промотором, транскрипция селективного маркерного гена (Neor) — внутренним промотором (р), 3'-LTR содержит сигнал полиаденилирования. ψ+ — последовательность, ответственная за упаковку. |
Генная терапия 489
тому была разработана методика упаковки полноразмерной РНК ретровирусного вектора в интактные вирусные частицы, с высокой частотой проникающие в клетку, что гарантирует встраивание соответствующей ей ДНК в геном клетки -хозяина. Для этого с помощью генной инженерии была создана «пакующая» клеточная линия, в одном из участков генома которой содержится ∆ψ+-сегмент 5'-LTR-gag-3'-LTR (т. е. сегмент, лишенный функциональной ψ+-последовательности), а в другом — ∆ψ+-сегмент 5'-LTR-pol-env-3'-LTR. Оба этих сегмента транскрибируются, но из-за отсутствия ψ+-последовательности и образования вирусных молекул РНК меньшего, чем в норме, размера формируются пустые вирусные частицы. При трансфекиии ДНК ретровирусного вектора в такие клетки она встраивается в хромосомную ДНК и транскрибируется с образованием полноразмерной РНК ретровируса, содержащей ψ+-последовательность. В таких условиях в вирусные капсиды упаковывается только РНК вектора. Образующиеся интактные вирусные частицы можно использовать для высокоэффективной доставки ретровирусного вектора в клетки-мишени (рис. 21.4).
В «пакующей» клеточной линии не образуются компетентные по репликации ретровирусы дикого типа, способные встраиваться в гены и приводить к некотролируемой пролиферации некоторых клеток (т. е. к превращению их в раковые клетки). Это весьма существенно, особенно если частицы ретровирусного вектора предполагается использовать для генной терапии соматических клеток человека. В качестве меры предосторожности все же проводят регулярное тестирование готовых ретровирусных векторов, с тем чтобы выявить ретровирусы дикого типа. Кроме того, в «пакующей" клеточной линии нуклеотидные последовательности ретровируса и вектора локализованы в трех разных областях хромосомы, что делает весьма маловероятной возможность последовательных рекомбинационных событий, которые могли бы привести к образованию компетентного по репликации ретровируса.
Ретровирусы активно инфицируют реплицирующиеся клетки. Для переноса генов в интенсивно растущие клетки-мишени последние обрабатывают очищенными частицами упакованного ретровирусного вектора либо проводят их совместное культивирование с производящей его клеточной линией, а затем осуществляют дифференциальную селекцию для разделения клеток-мишеней и «пакующих» клеток. Трансдуцированные клетки-мишени (те, в которые при помощи вируса была перенесена невирусная ДНК) тестируют, чтобы удостовериться, что: I ) в них синтезируется продукт терапевтического гена; 2) не образуются компетентные по репликации ретровирусы; 3) ДНК ретровирусного вектора не встроилась в сайт, изменяющий способность клеток к росту либо препятствующий их нормальному функционированию. После тестирования трансдуцированные клетки наращивают в больших количествах и с разными интервалами вводят пациенту.
Наиболее вероятными кандидатами для проведения генной терапии ex vivo (рис. 21.5) являются пациенты с наследственными заболеваниями, для лечения которых применяют трансплантацию костного мозга. Терапевтический эффект трансплантации костного мозга в отношении целого ряда болезней связан с наличием в нем тотипотентных эмбриональных стволовых клеток, которые встречаются с частотой 10~4—10~5, могут пролиферировать и дифференцироваться в различные типы клеток, такие как В- и Т-лимфоциты (B-клетки и Т-клетки), макрофаги, эритроциты, тромбоциты и остеокласты. Например, в том случае, когда генная мутация нарушает функции макрофагов, трансплантация костного мозга обеспечивает реципиенту постоянный запас компетентных макрофагов, происходящих из популяции тотипотентных стволовых клеток.
Генноинженерная модификация тотипотентных стволовых клеток с их последующей инфузией или трансплантацией пациенту для замещения утраченного типа клеток или генного продукта может стать основным способом генной терапии ex vivo. В качестве примера можно рассмотреть дефект АДА, приводящий к повышению в крови уровня аденозина и дезоксиаденозина, токсическое действие которых приводит к гибели В- и Т-лимфоцитов и развитию тяжелого иммунодефицита. Поскольку и В-, и Т-лимфоциты происходят из тотипотентных стволовых клеток, перенос в последние функционального гена АДА с последующим введением
490 ГЛАВА 21
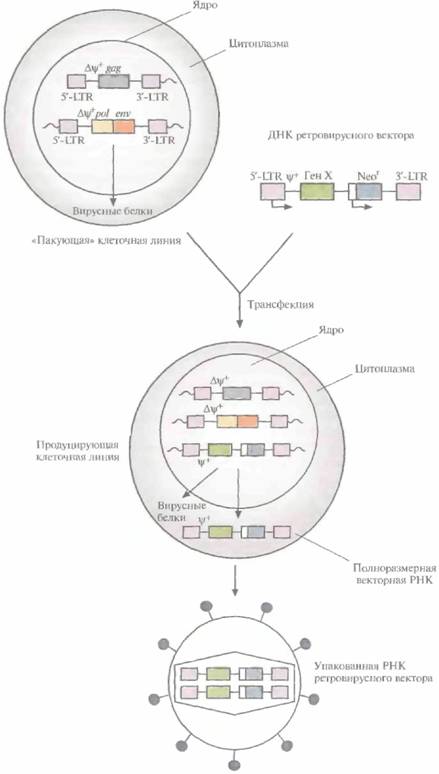
| Рис. 21.4. Получение упакованного ретровирусного вектора. В двух разных участках хромосом «пакующей» клеточной линии содержатся ретровирусные гены: в одном — gag, в другом — pol и env. Их транскрипция контролируется 5'-LTR-промотором; оба участка лишены последовательности, необходимой для упаковки (Δψ+). «Пакующая» линия клеток синтезирует вирусные белки, но из-за отсутствия в любой из ретровирусных мРНК последовательности, ответственной за упаковку, образуются пустые вирусные капсиды. После трансфекции «пакующей» линии клеток ретровирусным вектором, содержащим необходимую для упаковки последовательность (ψ+), его полноразмерные РНК транскрибируются и упаковываются в капсиды. Высвобождаемые вирусные частицы не способны реплицироваться и в данном случае содержат «терапевтический» ген (Ген X) и селективный маркерный ген (Neor). |
Генная терапия 491
| АДА-зависимый тяжелый комбинированный иммунодефицит |
| Адренолейкодистрофия |
| Синдром Чедиака— Хигаси |
| Хронический гранулематоз |
| Анемия Фанкони |
| Болезнь Гоше |
| Дефицит gpL-115 |
| Дефицит актина в гранулоцитах |
| Болезнь Хантера |
| Синдром Гурлера |
| Агранулоцитоз новорожденных (детский агранулоцитоз) |
| Болезнь Марото-Лами (мукополисахаридоз VI типа) |
| Метахроматическая лейкодистрофия |
| АДА-независимый тяжелый комбинированный иммунодефицит |
| Остеопороз |
| Дефицит пуринфосфорилазы |
| Ретикулярная дисплазия |
| Синдром Санфилиппо |
| Серповидноклеточная анемия |
| Талассемия |
| Синдром Вискотта— Олдрича |
| Х-сцепленная агаммаглобулинемия |
| Рис, 21.5. Наследственные заболевания, для лечения которых применяют трансплантацию костного мозга. |
их пациенту способствует понижению в крови уровней аденозина и дезоксиаденозина и предотвращает разрушение В- и Т-лимфоцитов. Стволовые клетки можно получить от самого пациента (оптимальный вариант) или от совместимых доноров, которых обычно нелегко найти.
К сожалению, тотипотентные стволовые клетки очень трудно выделять из костного мозга и культивировать. Исследования по ех vivo-генной терапии SCID, вызванного дефицитом АДА, проводили на аутологичных Т-клетках, модифицированных с помощью ретровирусных векторов. Т-лимфоциты имеют ограниченное время жизни, поэтому необходимо проводить их повторные инфузии. В первом испытании двум девочкам вливали с интервалом в несколько месяцев собственные генетически «исправленные» Т-клетки, продуцирующие АДА. Наблюдаемый положительный эффект, возможно, объяснялся снижением уровня аденозина и дезоксиаденозина в крови и предотвращением гибели В- и Т-клеток.
Т-клетки — не оптимальная система доставки, применяемая при генной терапии заболеваний гемопоэтических (происходящих из костного мозга) клеток. Предпочтительнее (хотя это не всегда возможно) использовать пуповинную кровь, содержащую стволовые клетки. Так, при однократном введении новорожденным с дефицитом АДА СО34+-клеток, полученных из их пуповинной крови и трансдуцированных кДНК АДА, эта кДНК поддерживалась и экспрессировалась в клетках крови неэритроидного ряда как минимум 18 мес.
В качестве примера успешной генной терапии ex vivo с использованием аутологичных клеток можно привести случай с пациенткой, гомозиготной по рецессивному гену семейной гиперхолестеролемии. Ее гепатоциты были лишены рецепторов липопротеинов низкой плотности (ЛПНП) и не разрушали холестерол; он постоянно циркулировал в крови, приводя к закупорке артерий и тяжелой болезни сердца. Лекарственные средства в подобных случаях неэффективны, а шунтирование коронарных артерий дает непродолжительный эффект.
В описываемом случае пациентке удалили около 15% печени, гепатоциты поместили в культуральную среду и ввели в них ДНК реком-бинантного ретровируса, содержащую кДНК ЛПНП-рецептора. Затем осуществили инфузию трансдуцированных гепатоцитов в печень пациентки, где они прижились, экспрессировали кДНК ЛПНП-рецептора и вырабатывали функциональный рецептор как минимум 18 мес. Если брать за основу показатели содержания липидов, то состояние пациентки значительно улучшилось. Более того, в ее организме не образовывались антитела кЛПНП-рецептору.
Генная терапия ex vivo основана на трансплантации генетически модифицированных клеток, производящих терапевтический белок. Использование собственных клеток пациента предотвращает их отторжение, но ограничивает сферу применения генной терапии ex vivo. Так, число клеток ткани-мишени может быть недостаточно для их извлечения и культивирования in vitro, некоторые соматические клетки неэффективно поглощают ДНК, а экспрессия клонированного гена иногда оказывается временной. Поэтому в настоящее время разрабатывают системы, которые защищают неаутологичные (ксе-ногенные, аллогенные) клетки от иммунного
492 ГЛАВА 21

|
| Создание «пакующей» клеточной линии и ее использование для производства хелпер-независимого дефектного ретровируса |
| R. Mann, R. С. Mulligan, D. Baltimore Сей 33: 153-159, 1983 |
| Вопрос о применении геной терапии всегда вызывал споры, но большинство ученых согласны с Т. Фридманом и Р. Роблином, которые еще в 1972 г. (Science 175: 949-955) писали: «Мы считаем, что геная терапия сможет облегчить симптомы некоторых наследственных заболеваний человека, поэтому необходимо продолжать исследования, направленные на ее развитие.» Ключевые моменты генной терапии — адресная доставка «терапевтического» гена и обеспечение его экспрессии в определенных клетках или тканях. Сначала в качестве основного средства доставки «терапевтических» генов рассматривали векторы, полученные на основе вирусов человека. Это было связано с наличием у них механизмов проникновения в специфические клетки. Наиболее многообещающими считали векторы на основе ретровирусов. Но нативный ретровирус — это инфекционный агент, который по- | вреждает клетки и нередко приводит к их злокачественной трансформации. Наиболее значимым достижением на пути практической реализации генной терапии стала разработка системы для упаковки «терапевтических" генов в инфекционные вирусные частицы, сохранившие способность прикрепляться к клеткам-хозяевам. Манн и др. сконструировали первую клеточную линию для упаковки ретровирусов. Для этого они встроили вирусный геном с предварительно удаленной нуклеотидной последовательностью, ответственной за упаковку, в хромосому клеточной линии, которая в этих условиях производит не инфекционные вирусные частицы. После трансфекции этих клеток ДНК-конструкцией, которая содержала последовательность, необходимую для упаковки, и терапевтический ген, но не содержала ретровирусные гены, | она упаковывалась в вирусные частицы, которые затем использовали для доставки «терапевтического» гена в нужные клетки. Этот подход был принят на вооружение другими исследователями, занимающимися генной терапией. Спустя несколько лет исходную «пакующую» клеточную линию адаптировали и для других вирусных векторов. В 1985 г., имея в виду результаты Манна и др., У. Андерсон отметил: «В последнее время появились эффективные системы доставки— экспрессии, которые позволяют сделать генную терапию реальностью». А 22 мая 1989 г. Андерсон и его коллеги начали первое клиническое испытание по генной терапии. Предпринимавшиеся до недавнего времени попытки генной терапии не отличались особым успехом, но полученная информация свидетельствует о том, что в будущем она станет вполне обычным методом лечения многих заболеваний. |
ответа и позволяют высвобождать «терапевтический» белок.
Неаутологичная генная терапия ex vivo включает выделение тканеспецифичных клеток, хорошо растущих в культуре (например, фибробластов или кератиноцитов кожи, астроцитов мозга, гепатоцитов или миобластов), и их генетическую модификацию с помощью «терапевтического» гена. Рекомбинантные клетки заключают в искусственную полупроницаемую полимерную мембрану, через которую выходит рекомбинантный белок и поступают в клетки питательные вещества. Мембрана неиммуногенна и не вызывает сенсибилизации пациента и отторжения имплантированных клеток. В качестве инкапсулирующего материала используют разные полимеры:
альгинат—поли-L-лизин—альгинат, полиэфир-сульфон, поли(акрилонитрил-ко-винилхлорид).
Доклинические испытания, проведенные in vitro и на модельных животных, показали, что инкапсулированные рекомбинантные клетки могут пролиферировать и длительное время производить большие количества рекомбинантного белка. Чтобы попытаться предотвратить гибель мотонейронов, приводящую к нейродегенеративному заболеванию боковому амиотрофическому склерозу, была проведена I фаза клинических испытаний с использованием инкапсулированных клеток, вырабатывающих цилиарный нейротрофический фактор (CNTF, от англ, ciliary neurotrvphic factor). Пропедуа была признана безопасной, но у пациентов с боковым
Генная терапия 493
амиотрофическим склерозом улучшения состояния не наблюдалось. При имплантации инкапсулированных CNT F-производящих клеток в мозг животных с химически индуцированным повреждением, моделирующим другое фатальное нейродегенеративное заболевание, хорею Гентингтона, клетки мозга не разрушались. Метод инкапсуляции клеток, модифицированных с помощью генной инженерии, находится на ранней стадии развития, но может стать эффективным способом доставки терапевтических генных продуктов при лечении многих заболеваний.
Генная терапия in vivo
Генная терапия in vivo предполагает доставку «терапевтического» гена непосредственно в клетки определенной ткани пациента (рис. 21.6). Ретровирусные векторы проникают только в делящиеся клетки-мишени, однако во многих тканях, на которые направлена генная терапия, большинство клеток не делится. Поэтому были разработаны разнообразные вирусные и невирусные векторные системы доставки «терапевтических» генов, учитывающие большое число потенциальных тканей-мишеней (кожа, мышцы, легкие, мозг, толстая кишка, селезенка, печень, клетки крови) и расположение их в организме человека. «Идеальная» система доставки должна обеспечивать высокую эффективность поглощения «терапевтического» гена клетками-мишенями, минимальность его внутриклеточного разрушения при транспорте в ядро и поддержание уровня экспрессии, достаточного для облегчения состояния больного.

|
| Рис. 21.6. Схематическое представление генной терапии in vivo. Клонированный «терапевтический» ген (Ген X) кодирует белок, корректирующий генетический дефект. Этот ген доставляется к клеткам определенной ткани пациента с наследственным заболеванием и экспрессируется в них. Промотор р, под контролем которого осуществляется транскрипция, тканеспецифичен . |
Вирусные системы доставки генов
Ретровирусные векторы
Опыт клинических испытаний с участием более 200 пациентов показывает, что дефектные по репликации ретровирусные векторы не оказывают каких-либо неблагоприятных побочных эффектов. Тем не менее безопасности их применения продолжают придавать большое значение. Создана конструкция, называемая плазмовирусом, которая содержит ретровирусные гены gag и pol, находящиеся под контролем 5'-LTR-промотора, a также «терапевтический» ген и ген env, управляемые цитомегаловирусным промотором. После трансфекции плазмовирус запускает образование дефектных по репликации вирусных частиц, причем вероятность рекомбинации с образованием компетентных по репликации ретровирусов очень мала. Вектор может переносить не более 3,5 т. п. и. ДНК, но и длина большинства потенциальных «терапевтических» кДНК и генов — супрессоров опухолей составляет 0,5—2 т. п. н.
В ретровирусную векторную систему внесены дополнительные усовершенствования: увеличено число образующихся вирусных частиц, повышена эффективность трансдукции, осуществлена генноинженерная модификация, обеспечивающая их проникновение в неделящиеся клетки, повышена специфичность инфекции, В последнем случае геном рекомбинантного ретровирусного вектора упаковывается в оболочку другого вируса, белок которой и определяет специфичность связывания ретровируса и спектр
494 ГЛАВА 21
инфицируемых им клеток. Это явление называется фенотипическим смешиванием (pseudotype formation). Фенотипически смешанный вирус получают с помощью котрансфекции клеточной линии, которая синтезирует продукты генов gag и pol, рекомбинантным ретровирусным вектором и вектором, экспрессирующим ген env другого вируса. Изменяя ген env, можно как сузить спектр инфицируемых вирусом клеток до строго определенного типа, так и расширить его. Кроме того, в ген env ретровируса можно встроить нуклеотидную последовательность, кодирующую пептид, который связывается с определенным клеточным рецептором и обеспечивает внедрение рекомбинантного ретровируса в нужные клетки. И наконец, можно добиться специфичности экспрессии терапевтического гена, осуществляя ее под контролем промотора, специфичного для определенных клеток.
Аденовирусные векторы
Аденовирусы инфицируют неделящиеся клетки человека и широко используются в качестве живых вакцин, которые предотвращают респираторные инфекции и гастроэнтериты, не оказывая побочного действия. Эти свойства делают аденовирусы перспективными для доставки генов в клетки-мишени.
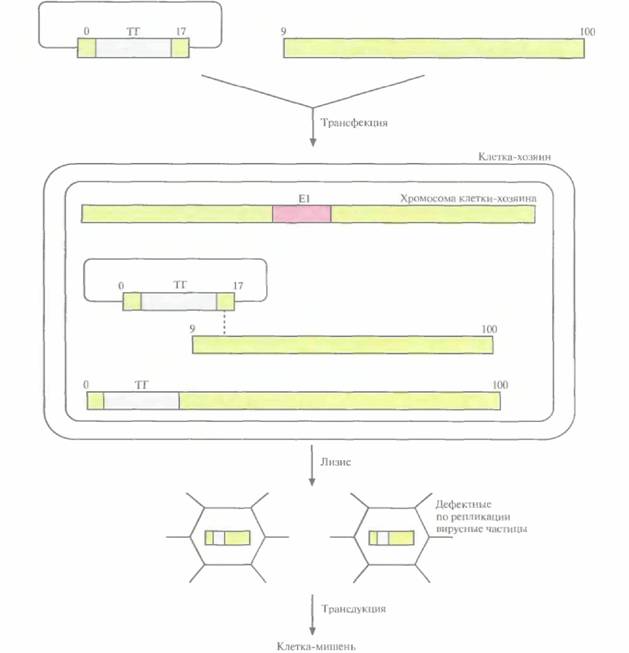
Для получения аденовирусного вектора провели котрансфекцию клеточной линии, синтезирующей продукты аденовирусного гена El, двумя участками генома аденовируса (рис. 21.7). Один из них может существовать в виде плазмиды в Е. coli и содержит вместо E1-области «терапевтический" ген, фланкируемый нуклеотидными последовательностями аденовируса, а второй представляет собой молекулу ДНК аденовируса, которая лишена 5'-концевого участка, включающего El-область, и имеет перекрывающийся участок с несущей терапевтический ген плазмидой. Рекомбинация между Двумя трансфицирующими фрагментами ДНК в области их перекрывания приводит к восстановлению полноразмерного аденовирусного гена, в котором вместо E1-области находится терапевтический ген. Продукты гена E1, поставляемые клеткой-хозяином, инициируют образование вирусных частиц, высвобождающихся из клетки в результате лизиса. Клонирующая емкость аденовирусного вектора составляет около 7,5 т. п. н. В отсутствие рекомбинации трансфицирующие молекулы ДНК, обладающие недостаточной длиной, не могут упаковываться в вирусные частицы. Вероятность того, что между областью El в геноме клетки-хозяина и ДНК рекомбинантного аденовируса произойдет рекомбинация с образованием компетентных по репликации вирусов, чрезвычайно мала.
После того как рекомбинантный аденовирус инфицирует клетку-мишень, его ДНК проникает в ядро, где и происходит экспрессия «терапевтического» гена. Рекомбинантная ДНК не интегрирует в хромосому и сохраняется непродолжительное время, поэтому при проведении генотерапии с использованием аденовирусных векторов необходимо вводить их с определенной периодичностью.
Аденовирусные векторы использовали в клинических испытаниях по генной терапии муковисцидоза. Первые результаты не обнадеживали: ген трансмембранного регуляторного белка, нарушения в котором приводят к муковисцидозу (CFTR, от англ, cystic fibrosis transmembrane regulator), был перенесен лишь в небольшое число клеток пациента, а многократное введение рекомбинантного аденовируса и низкий уровень экспрессии некоторых аденовирусных генов привели к развитию у пациентов выраженного иммунного ответа и гибели трансдуцированных клеток.
Эту проблему решали разными путями. Например, сконструировали «пакующую» клеточную линию, содержащую El-область и ряд аденовирусных генов, которые не входят в состав трансдуцирующей ДНК и не попадают в клетки-мишени. Затем удалось добиться того, чтобы ни один из аденовирусных генов не включался в трансдуцирующую ДНК. Для этого линеаризовали плазмиду Е. соli (28 т. п. н.), которая обеспечивает экспрессию одного или большего числа терапевтических генов и не содержит аденовирусных генов, и пришили к ее концам фрагменты ДНК (по 4 т, п. н.), содержащие точку начала репликации аденовирусной ДНК, последовательность, ответственную за ее упаковку, и сигнал терминации. Длина продукта лигирования (36 т. п. н.) соответствует длине полноразмерного генома аденовируса. Затем полученным продуктом и аденовирусным гено-
Геннаятерапия 495
|
| Рис. 21.7. Аденовирусный вектор, В клетку-хозяина, несущую интегрированный в геномную ДНК функциональный ген El аденовируса, вводят встроенную в сегмент аденовирусного генома (0—17 единицы карты) плазмиду с «терапевтическим» геном (ТГ) и участок геномной ДНК аденовируса (9—100 единицы карты). Длина генома аденовируса равна 100 единицам. В результате рекомбинации (штриховая линия) между перекрывающимися участками плазмиды и ДНК аденовируса образуется молекула ДНК, эквивалентная полноразмерному вирусному геному. Рекомбинантная ДНК, содержащая «терапевтический» ген, упаковывается и высвобождается из клетки после лизиса. Образующиеся вирусные частицы дефектны по репликации. Плазмидная ДНК, входящая в состав конечной генетической конструкции, не влияет на упаковку рекомбинантной ДНК (не показано). |
496 ГЛАВА 21
мом без E1-области и последовательности, ответственной за упаковку, провели котрансфекцию клетки-хозяина, экспрессирующей El-гены. Молекула ДНК аденовируса, дефектная по репликации и упаковке, поставляет гены для синтеза компонентов вируса, а продукт лигирования реплицируется и упаковывается в вирусные частицы. При этом около 99% высвобождаемых вирусных частиц содержат молекулу ДНК с «терапевтическим" геном (генами). С помощью центрифугирования их можно отделить от дефектных по репликации вирусов, которые все же образуются в незначительном количестве. ДНК-клонирующая емкость такой системы достигает 28 т. п. н.
Эффективность аденовирус-опосредованного переноса генов можно повысить, если сконструировать вирус, проникающий преимущественно в определенную клетку-мишень. Для этого в ген, ответственный за образование нитей аденовируса, следует включить последовательность, кодирующую домен белка, который связывается с клеточноспецифичным рецептором.
Векторы на основе аденоассоциированных вирусов
Аденоассоциированные вирусы (ААВ) — это небольшие непатогенные вирусы человека с одноцепочечным ДНК-геномом (4,7 т. n. H.), который может интегрировать в специфический сайт 19-й хромосомы. Такое название они получили потому, что для продуктивной инфекции им необходимы белки другого вируса (вируса-помощника), например аденовируса. После того как ААВ попадает в ядро, его геном с помощью полимераз клетки-хозяина преобразуется в двухцепочечную ДНК и транскрибируется.
Отсутствие патогенности делает ААВ весьма перспективным вектором для доставки в организм человека «терапевтических» генов. Рекомбинантный ААВ получают с помощью котранс-фекции клетки-хозяина, инфицированной каким-нибудь аденовирусом (вирусом-помощником), двумя плазмидами (рис, 21.8). Одна из них несет «терапевтический» ген, фланкированный инвертированными концевыми повторами (длиной от 125 п. н.) ААВ, а вторая — два его гена, rep и cap, ответственные за репликацию генома и синтез капсида соответственно. После лизиса инфицированных клеток рекомбинантные ААВ отделяют от аденовируса с помощью центрифугирования и диализа, а оставшиеся в образце аденовирусы (вирусы герпеса) инактивируют нагреванием. Рекомбинантный ААВ может нести ДНК-вставку размером до 4,5 т. п. н., не вызывает развития иммунного ответа, поскольку не содержит ААВ-генов, но и не может интегрировать в 19-ю хромосому из-за отсутствия гена rep.
В одном из доклинических испытаний эффективность in vivo трансдукции гепатоцитов мыши (рекомбинантный ААВ вводили внутривенно) была повышена в 900 раз с помощью предварительного облучения печени нетоксическими дозами и введения нерекомбинантного (дикого типа) ААВ. В этом случае кДНК фактора IX системы свертывания крови («терапевтический» ген) экспрессировалась в течение как минимум 5 мес на уровне, достаточном для коррекции дефекта при гемофилии. В I фазе клинических испытаний по генной терапии муковисцидоза в легкие вводили CFTR-AAB-вектор; при этом не развивалась воспалительная реакция, а вектор сохранялся до 70 сут. Чтобы определить, образуется ли продукт гена CFTR в количестве, достаточном для достижения терапевтического эффекта, нужны дальнейшие клинические испытания.
Векторы на основе вируса простого герпеса
Для того чтобы ретро- и аденовирусные векторы инфицировали специфические типы клеток, нужно модифицировать их с помощью генной инженерии, однако в природе существуют вирусы, уже обладающие сродством к определенному

|
| Рис. 21.8. Вектор на основе аденоассоциированного вируса (ААВ). Проведена котрансфекция клетки-хозяина, инфицированной аденовирусом-помощником, двумя плазмидами, одна из которых содержит «терапевтический» ген (ТГ). фланкированный инвертированными концевыми повторами (ITR) ААВ, а другая — гены ААВ, ответственные за репликацию (rep) и формирование капсида (cap), которые находятся под контролем промотора (р), и последовательность полиаденилирования (ра). Высвободившиеся после лизиса частицы рекомбинантного ААВ и аденовируса разделяют центрифугированием, а оставшиеся аденовирусные частицы инактивируют нагреванием. |
Генная терапия 497

|
Дата добавления: 2015-07-14; просмотров: 861;
