ГЛАВА 21. (IGF-IR), находящиеся в обратной ориентации под контролем металлотионеинового промотора, активируемого ZnSO4
(IGF-IR), находящиеся в обратной ориентации под контролем металлотионеинового промотора, активируемого ZnSO4. IGF-l вырабатывается в избыточном количестве клетками злокачественной глиомы, наиболее распространенной опухоли головного мозга, a IGF-1R — клетками карциномы предстательной железы.
Вектор, обусловливающий синтез «антисмысловой» мРНК IGF-1, трансфицировали в культуру клеток глиомы. Если ZnSO4 в культуральной среде отсутствовал, то гиперпродукция IGF-1 опухолью сохранялась, если же в среду добавляли ZnSO4, то она исчезала. В другом эксперименте изучали последствия введения крысам нетрансфицированных клеток глиомы и клеток, трансфицированных «антисмысловой» кДНК IGF-1. В первом случае опухоли развивались, а во втором — нет.
Если клетки карциномы предстательной железы крыс, трансфицированные «антисмысловой» кДНК IGF-IR, вводили мышам, то у них образовывались лишь небольшие опухоли или не образовывались совсем. Если же им вводили нетрансфицированные или трансфицированные нормальной кДНК IGF-1R клетки, то развивались опухоли большого размера. По-видимому, в обоих случаях «антисмысловая» РНК гибридизуется с комплементарной ей мРНК и ингибирует трансляцию IGF-1 и IGF-1R, предотвращая пролиферацию опухолевых клеток.
«Антисмысловые» олигонуклеотиды как лекарственные средства
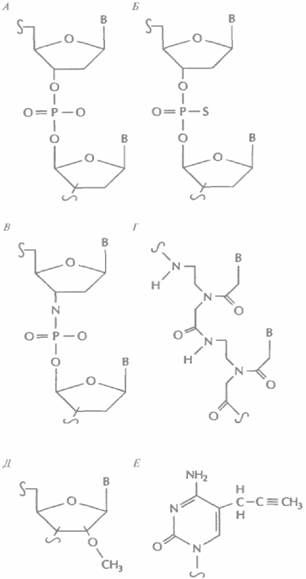
Терапевтический эффект синтетических «антисмысловых» олигонуклеотидов зависит от специфичности их гибридизации с доступным сайтом мРНК-мишени, устойчивости к действию клеточных нуклеаз и наличия системы доставки в клетку. 15—20-нуклеотидные последовательности гибридизуются с уникальными мРНК с достаточно высокой специфичностью. Потенциальные сайты-мишени определяют тестированием набора «антисмысловых» олигонуклеотидов с использованием культуры клеток, синтезирующих мРНК-мишень. Для этого проводят электрофоретическое разделение клеточных белков, в которые включают радиоактивную метку во время трансляции, и с помощью радиоавтографии устанавливают, в присутствии какого из «антисмысловых» олигонуклеотидов снижается синтез определенного белка. Никаких общих критериев выбора наилучших сайтов-мишеней в разных РНК-транскриптах не существует. Эффективными могут оказаться олигонуклеотиды, комплементарные 5'- или 3'-концам мРНК, границам экзонов и интронов и даже двухцепочечным областям. Олигодезоксинуклеотиды разрушаются внутриклеточными нуклеазами, поэтому важно защитить их от действия последних так, чтобы они не утратили способности к гибридизации с мишенью. Для этого можно модифицировать определенным образом пиримиаиновые основания и дезоксирибозу (рис. 21.14). Так, у наиболее широко применяющихся сейчас «антисмысловых» олигонуклеотидов свободный атом кислорода фосфодиэфирной связи заменен на сульфогруппу (рис. 21.14, Б), в результате чего образуется тиофосфатная связь. Модифицированные таким образом олигонуклеотиды растворяются в воде, несут отрицательный заряд и не расщепляются под действием эндонуклеаз. При гибридизации с сайтом-мишенью они образуют РНК—ДНК-дуплексы, которые активируют рибонуклеазу (РНКазу) Н, эндогенный фермент, расщепляющий мРНК в гибридной молекуле. Проведены первые клинические испытания таких олигонуклеотидов — лекарственных средств «первого поколения». Мишенями являются РНК цитомегаловируса, вируса иммунодефицита человека, а также мРНК генов, ответственных за развитие рака, болезней кишечника и других заболеваний.
Синтезированы «антисмысловые» олигонуклеотиды с фосфорамидитной и полиамидной (пептидной) связями (рис. 21.14, В и Г). Такие молекулы очень устойчивы к действию нуклеаз. Химические группы, присоединенные к 2'-углеродному атому сахарного остатка и С-5-атому пиримидинов, также защищают «антисмысловые» олигонуклеотиды и облегчают их связывание с сайтом-мишенью (рис. 1.14, Д и Е). Все преимущества этих и других модификаций сейчас интенсивно изучаются.
Проникновение «антисмысловых» олигонуклеотидов в клетку можно значительно облегчить, поместив их в липосомы. Такая высоко-
Генная терапия 507
|
| Рис. 21.14. Модификации «антисмысловых» олигонуклеотидов. А. Фосфодиэф ирная связь. Б. Тиофосфатная связь. В. Фосфорамидитная связь. Г. Полиамидная связь (пептидная нуклеиновая кислота). Д. 2'-О-метилрибоза. Е. С-5-пропинилцитозин. |
эффективная система доставки позволяет использовать «антисмысловые» олигонуклеотиды в небольших концентрациях. Если же конъюгировать липосомы с сайтами связывания, специфичными для определенных клеток, то можно будет осуществлять адресную доставку олигонуклеотидов.
Проведенные доклинические испытания показали, что «антисмысловые» олигонуклеотиды являются весьма эффективными лекарственными средствами. Изучена возможность их применения для лечения стеноза коронарных и сонных артерий, который приводит к инфарктам и инсультам. В этих случаях часто прибегают к ангиопластике, расширению артерий с помощью баллонного катетера, но примерно у 40% больных через 6 мес вновь возникают стенозы, поскольку ангиопластика стимулирует пролиферацию гладкомышечных клеток и секрецию межклеточного вещества во внутренний слой артерии в месте ее расширения. В одном из экспериментов в сонные артерии крыс после ангиопластики вводили «антисмысловые» олигонуклеотиды с тиофосфатными связями, комплементарные мРНК, которые кодируют важные для клеточного цикла млекопитающих белки; в результате частота повторных стенозов уменьшилась на 90%. Пролиферация гладкомышечных клеток происходит также при атеросклерозе, сахарном диабете, осложнениях после коронарного шунтирования. Вероятно, все эти состояния можно будет контролировать аналогичными способами.
«Антисмыдовые» олигонуклеотиды можно применять и для лечения вирусных инфекций и малярии. Кроме того, результаты I фазы клинических испытаний лечения болезни Крона с помощью орального введения «антисмыслового» олигонуклеотида проиллюстрировали четко выраженный терапевтический эффект без заметных побочных эффектов, В этом случае мРНК-мишень кодировала межклеточный адгезии типа 1, который вырабатывается в избытке у пациентов с болезнью Крона. Предполагается исследовать эффективность этого же олигонуклеотида для терапии других воспалительных заболеваний, например ревматоидного артрита, псориаза и язвенного колита.
В принципе « антисмысловые» олигонуклеотиды могут образовывать тройную спираль с хромосомной ДНК-мишенью и блокировать транскрипцию. Однако пока специфичность «антигенных» олигонуклестидов не соответствует стандартам, принятым для лекарственных средств.
508 ГЛАВА 21
Олигонуклеотиды, связывающиеся с белками: антитромбиновый аптамер
Блокировать экспрессию гена-мишени можно не только с помощью «антисмысловой» терапии, но и введением в клетку олигонуклеотида, связывающегося с фактором транскрипции или трансляции, однако этот подход пока недостаточно изучен. Далее, поскольку нуклеиновые кислоты способны связываться с белками, можно синтезировать такой олигонуклеотид (так называемый аптамер), который будет присоединяться к определенному белку, в норме не связанному ни с какими нуклеиновыми кислотами, и блокировать его функцию. Так, анти-тромбиновый аптамер может стать недорогим средством профилактики тромбообразования при различных хирургических вмешательствах.
Для его получения использовали набор химически синтезированных олигонуклеотидов, состоящих из 18-нуклеотидных фланкирующих областей (праймеров) и центрального 60-нуклеотидного участка, где в каждом из 60 положений может находиться любой из четырех нуклеотидов. Теоретически такой набор содержит примерно 1,3 · 1036 (460) олигонуклеотидов с разной центральной последовательностью. Образец пропустили через колонку, содержащую связанные молекулы тромбина, присоединившиеся к тромбину олигонуклеотиды элюировали и повторно пропустили через колонку со связанным тромбином. Эту процедуру повторяли не менее трех раз. Конечный набор тромбиновых аптамеров амплифицировали с помощью ПЦР и клонировали, после чего определили физические и биологические свойства каждого из них. Те аптамеры, которые обладали высокими сродством, специфичностью и антитромбиновой активностью, отбирали для более детального анализа.
Таким образом был получен эффективный антитромбиновый аптамер, К сожалению, вследствие малого времени жизни in vivo его можно использовать только для временного ингибирования функции тромбина (например, при кардиопульмонарном шунтировании), а в тех случаях, когда необходимо длительное введение противосвертывающих веществ (например, при ангиопластике), он неприменим. Очевидно, что описанную процедуру идентификации аптамеров можно использовать и в случае других белков-мишеней.
Рибозимы как лекарственные средства
Рибозимы — это природные РНК, обладающие каталитической активностью (РНК-ферменты); их субстратсвязывающий домен присоединяется к комплементарной РНК-мишени с помощью водородных и, возможно, других связей, а каталитический расщепляет ее в специфическом сайте. Модифицируя субстратсвязывающую последовательность, можно получить рибозим, специфичный в отношении определенной мРНК (рис. 21.15).
Создание «терапевтического» рибозима — сложный процесс. Связано это с трудностью получения больших количеств синтетических РНК и сохранения их в нативном состоянии в клетке-мишени. В одном из экспериментов синтезировали олигодезоксинуклеотид, который содержал каталитический домен (примерно 20 нуклеотидов), фланкированный гибридизующимися с мРНК-мишенью последовательностями (они же выступали в роли праймеров), амплифицировали его, встроили в эукариотический экспрессирующий вектор и трансфицировали полученной конструкцией клетки. Образовавшийся после транскрипции рибозим расщеплял мРНК-ми-

|
| Рис. 21.15. Расщепление мРНК под действием рибозима. Рибозим, субстратсвязывающий домен которого модифицирован с помощью генной инженерии, гибридизуется с мРНК-мишенью и расщепляет ее в специфическом сайте (показано стрелкой). (Из работы Tone et al., In Vivo 7: 471—476, 1993, с изменениями.) |
Генная терапия 509
шень и подавлял трансляцию белка, ответственного за развитие того или иного заболевания. Рибозимы, созданные методами генной инженерии, можно использовать для лечения рака и вирусных инфекций.
Природных ДНК-ферментов (дезоксирибозимов) пока не обнаружено, но уже синтезированы олигодезоксинуклеотиды, обладающие каталитической активностью. Преимущество дезоксирибозимов состоит в том, что для их получения не нужно использовать экспрессирующий вектор: ДНК-ферменты можно упаковать в липосомы и доставить в клетку-мишень. Однако создание эффективных ДНК-ферментов находится пока на начальном этапе развития.
Коррекция генетических дефектов с помощью олигонуклеотидов
Многие генетические дефекты можно скорректировать, заменив связанную с данным дефектом пару нуклеотидов в мутантном гене на «правильную» пару. В одном из экспериментов для этой цели использовался 68-членный химерный (ДНК-РНК) олигонуклеотид, который образует шпильку с двумя головками и содержит метилированный кислород при 2'-углерод-ном атоме рибозы (рис. 21.16). Выбор такого необычного олигонуклеотида основывается на следующих экспериментальных данных: 1) ге-теродуплексы РНК-ДНК легче, чем двухцепочечные ДНК, спариваются с гомологичными нуклеиновыми последовательностями; 2) го-
ловки шпилек, не участвующие в спаривании, защищают олигонуклеотид от экзонуклеаз; 3) 2'-О-метилирование предотвращает разрушение молекулы РНКазой Н. Важно и расположение нуклеотидов в химерной молекуле: десять рибонуклеотидов фланкируют пять центральных дезоксирибонуклеотидов, причем этот сегмент имеет одинаковую с мишенью последовательность и содержит нормальную пару нуклеотидов.
Возможность коррекции мутаций с помощью химерных олигонуклеотидов изучали с использованием как кДНК, входящей в состав плазмиды, так и хромосомной ДНК. В обоих случаях мутантный сайт с высокой частотой заменялся нормальным. Но для того чтобы химерные олигонуклеотиды стали эффективными лекарственными средствами, необходимы дополнительные исследования.
Если мутация в интроне распознается системой процессинга РНК как аутентичный сайт сплайсинга, то в процессированную мРНК включается часть интрона (рис. 21.17, А). Это приводит к сдвигу рамки считывания и образованию укороченного белка. При этом количество нормального белка снижается, что может стать причиной заболевания. Разумно предположить, что если «антисмысловой» олигонуклеотид, комплементарный мутантному интрону, гибридизуется с ним, то ошибочный сплайсинг блокируется, что повысит вероятность сплайсинга в нормальном сайте. Это предположение проверили на ß-глобиновом гене с мутацией во

|
| Рис. 21.16. Исправление генетического дефекта, состоящего в замене одной пары нуклеотидов, с помощью химерного олигонуклеотида. Стрелкой указаны мутантный сайт в последовательности-мишени и нормальная пара оснований в химерном олигонуклеотиде. Соответствующие нуклеотиды подчеркнуты. Прописными буквами обозначены дезоксирибонуклеотиды, а строчными — рибонуклеотиды. Жирным шрифтом выделены нуклеотиды, образующие головки шпильки. Вертикальная черта указывает 3'- и 5'-концы химерного олигонуклеотида. (Из работы Yoon et al.T Proc. Natl. Acad. Sei. USA 93: 2071 -2076, 1996, с изменениями.) |
510 ГЛАВА 21
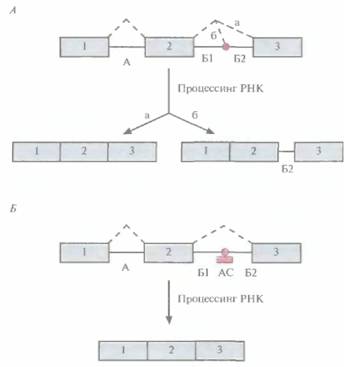
| Рис. 21,17. Коррекция дефекта, приводящего к ошибочному сплайсингу, с помошью «антисмыслового» олигонуклеотида, А. Результат мутации, приводящей к ошибочному сплайсингу. Обозначения: цифры — экзоны, А -первый интрон, Б — второй интрон, содержащий мутацию (красный кружок), разделяющую его на две части (Б 1 и Б2). Штриховые линии охватывают сегменты РНК, вырезаемые при процессинге. Возможны два варианта сплайсинга: вариант а приводит к образованию функциональной мРНК, вариант 6 — к образованию РНК, включающей часть второго интрона (Б2). Б. «Антисмысловой» олигонуклеотид (АС), связывающийся с мутантным сайтом сплайсинга, препятствует его распознаванию при процессинге, ив результате образуется только функциональная мРНК. |
втором интроне (рис. 21.17, Б), обусловливающей одну из форм ß-талассемии, наследственного заболевания крови, которое приводит к разрушению эритроцитов (анемии). В клетки, гомозиготные по мутантному гену (1VS2-654), ввели содержащий тиофосфатные связи «антисмысловой» 2'-О-метилолигонуклеотид, комплементарный мутантному сайту сплайсинга. В результате число нормальных ß-глобиновых цепей увеличилось на 50%. Дальнейшие исследования покажут, является ли этот подход достаточно эффективным для лечения талассемии и других состояний, вызванных подобными мутациями.
ЗАКЛЮЧЕНИЕ
Для многих наследственных заболеваний никаких достаточно эффективных способов лечения не существует, и во многом это связано с трудностями получения и адресной доставки соответствующего генного продукта. После разработки методов идентификации и клонирования нормальных вариантов дефектных генов (часто в виде кДНК) были предприняты попытки использовать их для коррекции генетических дефектов. Для лечения заболеваний на молекулярном уровне применяются два основных подхода: генная терапия ex vivo и генная терапия in vivo.
При генной терапии ex vivo «терапевтический» ген переносят в изолированные клетки больного с помощью ретровирусных векторов или других систем доставки, трансдуцированные клетки культивируют и вводят пациенту. При этом у реципиента не развивается нежелательного иммунного ответа, но сама процедура является весьма дорогостоящей и трудоемкой. Альтернативный способ генной терапии ех vivo использует генноинженерную модификацию неаутологичных клеток, заключенных в мембрану, которая предотвращает развитие нежелательного ответа и не препятствует высвобождению «терапевтического» генного продукта.
При генной терапии in vivo «терапевтический» ген вводят непосредственно в клетки ткани-мишени больного. Для этого разработаны разные системы доставки: вирусные (ретрови-
Генная терапия 511
русные, аденовирусные, аденоассоциированные векторы и векторы на основе вируса простого герпеса) и невирусные (инъекция чистой ДНК, бомбардировка ткани-мишени частицами, конъюгированными с ДНК, захват клетками ДНК, заключенной в липидную оболочку). Кроме того, разработаны вирусные и невирусные системы доставки генов, специфичные для определенных клеток.
Весьма перспективным способом разрушения быстроделящихся раковых клеток представляется генная активация лекарственного вещества. При этом наиболее широко используется подход, включающий последовательное введение в опухолевые клетки гена тимидинкиназы вируса простого герпеса (HSVtk) и ганциклови-ра. В результате образуется ганцикловиртрифосфат, токсичный для быстроделящихся клеток. Погибают и нетрансформированные клетки, контактирующие с HSVtk-модифицированными клетками («эффект свидетеля»).
В качестве лекарственных средств можно использовать не только генные продукты, но и олигонуклеотиды. С помощью так называемых «антисмысловых» олигонуклеотидов можно подавить полностью или частично экспрессию гена того или иного наследственного заболевания. В одном из вариантов такой терапии клонированный ген встраивают в экспрессирующий вектор в обратной ориентации, в результате чего образуется комплементарный нормальной мРНК ДНК-транскрипт, который спаривается с ней и ингибирует трансляцию. В более распространенном варианте введенный в клетку-мишень «антисмысловой» олигонуклеотид гибридизуется со специфической мРНК и блокирует ее трансляцию. Эффективность «антисмысловых» олигонуклеотидов и время их жизни повышаются в результате модификаций, затрагивающих фосфодиэфирную связь, пиримилины и остатки Сахаров. В настоящее время изучается терапевтическое действие различных олигонуклеотидов: модифицированных с помощью генной инженерии рибозимов, расщепляющих специфические мРНК; аптамеров, которые связываются со специфическими белками и блокируют их функции; олигонуклеотидов, с помощью которых можно корректировать замену одной нуклеотидной пары и мутации, приводящие к неправильному сплайсингу.
Дата добавления: 2015-07-14; просмотров: 824;
