Правило изотермы и адиабаты.
Очень часто в инженерных задачах и в физико-химическом исследовании процессов с рабочим телом необходимо знать только знак изменения функций состояния Δu, Δh, Δs и функций процесса q, w. Сама величина этих изменений бывает и не нужна. Для решения этой задачи существует прием, позволяющий очень просто и наглядно ответить на поставленный вопрос.
Рассмотрим рис. 3.3.
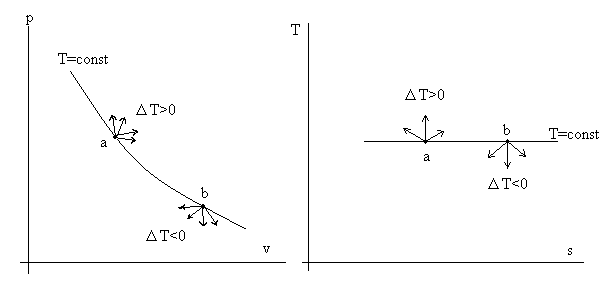
Рис 3.3. Иллюстрация правила изотермы.
На изотерме T = const возьмем произвольную точку «а». Наверное, понятно, что все процессы, выходящие из точки «а» на изотерме «вверх» (см. диаграмму T – s), характеризуются ростом температуры ΔT > 0. Зато все процессы, выходящие из точки «в» «вниз» (опять см. диаграмму T – s), дают ΔT < 0.
Рассмотрим рис.3.4.
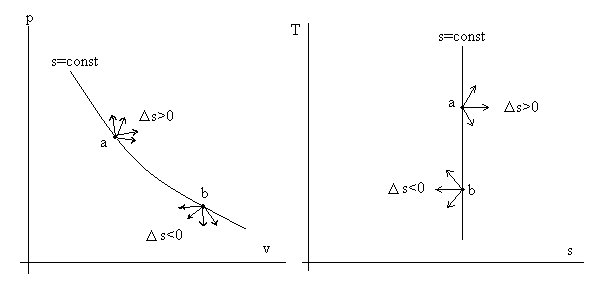
Рис. 3.4. Иллюстрация правила адиабаты.
На адиабате s = const возьмем произвольную точку «а». Все процессы, выходящие из т. «а» вправо (см. диаграмму T – s), характеризуются ростом энтропии Δs > 0. Все процессы, выходящие из точки «в» влево (опять см. диаграмму T – s) характеризуются уменьшением энтропии Δs < 0.
Практическую работу правила изотермы и адиабаты проиллюстрируем на примере.
Пример.Определить знаки изменения энтропии Δs, функций состояния Δu, Δh и функций процесса q и w для процесса расширения идеального газа с показателем политропы n = 0,8.
Дата добавления: 2015-08-21; просмотров: 769;
