со свойствами реальных газов и веществ.
Эту методику продемонстрируем на конкретном примере: рассмотрим изохорный процесс v = const и рабочее вещество – Н2О (μ = 18 кг/кмоль), а рассчитывать процесс будем дважды, сначала как для идеального газа, потом как для реального вещества.
Текст задачи.В реакторе объемом V = 0,75 м3 под давлением р1 = 10 бар и при температуре t1 = 1800С находится вода в количестве m = 3,85 кг. При подводе внешней теплоты давление поднимается до р2 = 16 бар. Определить температуру t2 в конце нагрева, количество подведенной теплоты и изменение энтропии.
Решение (Н2О – идеальный газ).
1. Температура воды в реакторе в конце процесса нагрева:
v = const → T2 / T1 = p2 / p1 → T2 = T1p2 / p1 = (273 + 180)16 / 10 = 724K = 4510C.
2. Количество подведенной теплоты:
Q = mq = mcv|t1t2(t2 – t1).
По таблицам теплоемкостей для водяного пара имеем:
μсp|0180 = 34,195 кДж/кмольК, μсp|0451 = 35,364 кДж/кмольК.
Тогда средняя изобарная массовая теплоемкость равна:
cp|180451 = (μcp|0t2t2 – μcp|0t2t1) / μ(t2 – t1) = (35,364*451 – 34,195*180) / 18(451 – 180) = 1,972 кДж/кгК.
По уравнению Майера находим среднюю изохорную массовую теплоемкость:
cv|180451 = cp|180451 – R/μ = 1,972 – 8,314 / 18 = 1,512 кДж/кгК.
Окончательно, Q = 3,85*1,512*(451 – 180) = 1577,5 = 1580 кДж.
3. Изменение энтропии за процесс нагрева:
Δs = cv|t1t2 lnT2/T1 = 1,512 ln (273 + 451)/(273 + 180) = 0,70897 = 0,709 кДж/кгК.
ΔS = m*Δs = 3,85*0,709 =2,73 кДж/К.
Ответ:t2 = 4510C, Q = 1580 кДж, ΔS = 2,73 кДж/К.
Решение ( Н2О – реальное вещество).
Решать будем с помощью таблиц для воды (см. фрагмент таблицы, представленный выше).
1. Начальное состояние воды. Известно, что
р1 = 10 бар и v1 = V/m = 0,75/3,85 = 0,1948 = 0,195 м3/кг = const.
По таблицам насыщенных паров воды (по давлениям, т.к. дано р1 = 10 бар, см. выше фрагмент таблицы насыщенных паров воды) определяем температуру фазового перехода tнас = 179,880С. Одновременно, обращаем внимание, что v΄΄ = 0,1946 м3/кг. Получилось, что
tнас = 179,880С ≈ 1800С и v΄΄ = 0,1946 м3/кг ≈ v1 = 0,195 м3/кг.
Следовательно, в начальном состоянии вода находится в состоянии сухого насыщенного пара.
2. Температура в реакторе после нагрева.
Определяем состояние воды после нагрева. При р2 = 16 бар по той же таблице имеем v΄΄ = 0,1238 м3/кг. Но при v = const v2 = 0,195 м3/кг. Следовательно, v΄΄ < v2, и делаем вывод: в конце процесса нагрева вода находится в состоянии перегретого пара.
Открываем таблицу перегретого пара для воды, зная, что р2 = 16 бар и v2 = 0,195 м3/кг, находим величину температуры: t2 = 4160C.
3. Количество подведенной теплоты в процессе нагрева реактора.
q = u2 – u1, т.к. v = const. u = h – pv.
u1 = h1 – p1v1 = h΄΄(p1 = 10 бар) – p1v1 = 2778 – 10*105*0,195*10-3 = 2583,4 = 2580 кДж/кг.
Здесь величину h1 = h΄΄ = 2778 кдж/кг взяли из той же таблицы насыщенного водяного пара, а v1 = v = 0,195 м3/кг. Величина 10-3 во втором слагаемом просто переводит размерность его в кДж/кг.
u2 = h2 – p2v2 = 3288,2 – 16*105*0,195*10-3 = 2976,8 = 2980 кДж/кг.
Здесь величину h2 = 3288,2 кдж/кг нашли по таблице для перегретого водяного пара при р2 = 16 бар и v2 = 0,195 м3/кг. Отсюда
q = 2980 – 2580 = 400 кДж/кг. Q = 3,85*400 = 1540 кДж.
4.Изменение энтропии: Δs = s2 – s1 = s2 – s΄΄(p1 = 10 бар) = 7,283 – 6,587 = 0,696 кДж/кгК.
ΔS = m*Δs = 3,85*0,696 = 2,6796 = 2,68 кДж/К.
Ответ:t2 = 4160C, Q = 1540 кДж, ΔS = 2,68 кДж/К.
Сравнивая ответы решения одной и той же задачи для водяного пара как идеального газа и как реального вещества, видно, что погрешность расчета Q и ΔS находится в нормальных пределах (2 – 3)%, как это принято в химической технологии. Зато погрешность определения температуры t2 великовата:
δt2 = Δt2/t2 = (451 – 416)/416*100% = 8,4%.
На рис. 3.8 приведена иллюстрация решения задачи двумя способами.
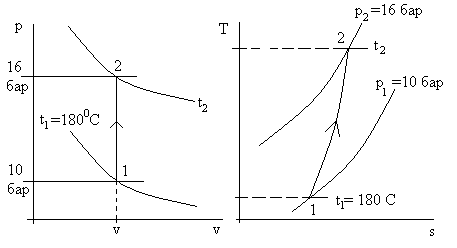
Рис. 3.8а. Изображение процесса в рассмотренной задаче
в осях р – v и T – s. H2O – идеальный газ. Величины Т2, q ,Δs – искомые.
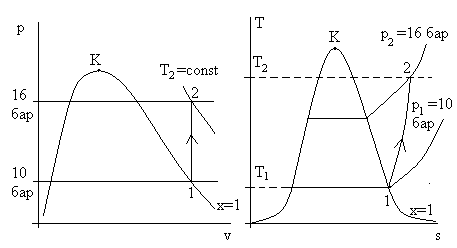
Рис. 3.8б. Изображение процесса в рассмотренной задаче
в осях p – v и T – s. H2O – реальное вещество. Величины Т2, q, Δs – искомые.
Замечание.Методика расчета процессов с реальными веществами по таблицам кажется сложной только в том, что сначала надо определить фазовое состояние вещества в начальной и конечной точке процесса, а потом уже пользоваться соответствующими таблицами для поиска необходимых термодинамических величин. Использование фазовых диаграмм для расчета процессов вообще трудностей не представляет, хотя точность расчета меньше, чем при пользовании таблиц.
Дата добавления: 2015-08-21; просмотров: 654;
