Уравнение процесса.
В лекции 2 довольно кратко уже говорилось о политропе, теперь – подробнее.
Уравнение политропического процесса имеет вид:
pvn = const, n = const.
Но это не единственная форма связи параметров состояния, возможны комбинации:
pTn΄ = const, n΄ = const или vTn΄΄= const, n΄΄= const.
Далее, для примера, будем работать с уравнением pvn = const, n = const.
На практике показатель политропы n находят экспериментально следующим образом:
pvn = const → lnp + nlnv = const → lnp = - nlnv + const.
Последнее выражение представляет собой уравнение прямой линии в координатах lnp – lnv. В эксперименте с каким-то веществом для различных условий измеряют давление р и удельный объем v с какой-то инструментальной точностью. Далее строят график в осях lnp – lnv (см. рис. 3. 1) и по нему находят показатель политропы n.
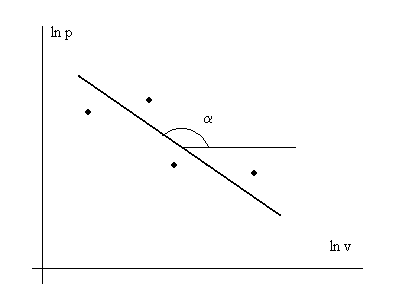
Рис. 3. 1. Иллюстрация к экспериментальному определению
показателя политропы n – индикаторная диаграмма
в логарифмических координатах. n = - tgα.
· - обозначение экспериментальных точек.
Истоки вывода уравнения pvn = const уходят в анализ работы реальных поршневых машин (паровых и компрессоров). При анализе их работы снимали индикаторную диаграмму p = f(x), где х – ход поршня. От индикаторной диаграммы всего один шаг до p – v диаграммы.
Показатель политропы n в уравнении pvn = const в сущности отражает интенсивность изменения параметров в процессе, т.е. характер смены состояний. А параметры изменяются под влиянием внешних воздействий q и w на термодеформационную систему. Поэтому мы в праве ожидать, что n = n(q,w). Проверим это ожидание.
Исходное уравнение политропы pvn = const в логарифмической форме
lnp = -nlnv + const
после дифференцирования принимает вид:
dp/p = -n dv/v или n = -vdp/pdv (3.1)
Иными словами: показатель политропы n есть отношение элементарной работы проталкивания к элементарной работе деформации (сжатия или расширения), и наши ожидания подтвердились.
Далее, вспомним первый закон термодинамики в форме
du = dq – dw → du = dq – pdv → pdv = dq – du; (3.2.1)
dh = dq +dw΄ → dh = dq +vdp → vdp = dh – dq; (3.2.2)
Подстановка (3.2.1) и (3.2.2) в (3.1) дает результат:
n = (dq – dh) / (dq –du). (3.3)
В лекции 2 подробно рассматривалось понятие теплоемкости и было показано, что dq = cdT. Одновременно, для идеального газа и любого процессабыли получены связи
du = cvdT и dh = cpdT.
Тогда зависимость (3.3) для идеального газа принимает вид:
n = (cdT – cpdT) / (cdT – cvdT) = (c – cp)/(c – cv). (3.4)
Следовательно, показатель политропы n для идеального газа получил вполне определенный смысл – это функция теплоемкостей.
Из (3.4) попутно получим зависимость истинной политропной теплоемкости сn от показателя политропы n , чтобы можно было рассчитывать количество теплоты так, как это принято в калориметрии dq = cndT. Действительно (см. (3.4)),
c ≡ cn = (ncv –cp) / (n – 1) = cv (n – k) / (n – 1). (3.5)
В (3.5) величина k ≡ ср/сv носит название коэффициента Пуассона и является показателем адиабаты. Для двухатомных газов k ≈ 1,4. Так как n = const и k = const, то (3.5) справедливо и для средней политропной теплоемкости:
cn|t1t2 = cv|t1t2(n – k) / (n – 1), k = cp|t1t2 / cv|t1t2. (3.6)
Дата добавления: 2015-08-21; просмотров: 1634;
