ГЛАВА 10. Профилактика отторжения трансплантированных органов
Профилактика отторжения трансплантированных органов
В 1970-х гг. были пересмотрены взгляды на пассивную иммунизацию: ее стали считать профилактическим средством борьбы с отторжением трансплантированных органов. Предлагалось вводить пациентам специфические антитела, которые будут связываться с лимфоцитами определенного типа, уменьшая иммунный ответ, направленный против пересаженного органа.
Первыми веществами, рекомендованными Департаментом по контролю за качеством пищевых продуктов, медикаментов и косметических средств (США) для использования в качестве иммуносупрессоров при пересадке органов у человека, были моноклональные антитела мыши ОКТЗ. За отторжение органов отвечают так называемые Т-клетки — лимфоциты, дифференцирующиеся в тимусе. ОКТЗ связываются с рецептором, находящимся на поверхности любой Т-клетки, который называется CD3. Это предупреждает развитие полного иммунного ответа и отторжение трансплантированного органа. Подобная иммуносупрессия весьма эффективна, хотя и оказывает некоторые побочные действия, например вызывает лихорадку и приводит к появлению сыпи.
Лекарственные вещества, связанные с моноклональными антителами
Лекарственные вещества, проявляющие высокую ахтивность при тестировании in vitro (обычно в культуре клеток), зачастую оказываются значительно менее эффективными in vivo. Кажущееся снижение их активности объясняется тем, что они не достигают органа или клетки-мишени в нужной концентрации. Увеличение дозы принимаемого препарата не решает проблему, поскольку при этом часто возникают побочные эффекты. Более того, чтобы избежать таких эффектов, многие терапевтические средства заведомо вводят в дозах, не достигающих оптимальных, что дополнительно снижает их эффективность. Для облегчения доставки лекарственного вещества к месту его действия используют несколько приемов. 1. Заключают его в особые частицы — липосомы, липидная обо-
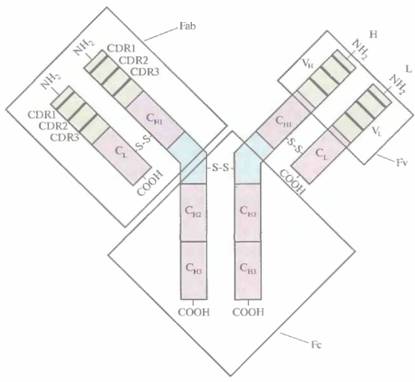
| Рис. 10.5. Строение молекулы антитела. Н- и L-цепи состоят из вариабельных (VH и VL ) и константных (CL, CH1, СН2 и СH3) доменов. Вариабельные домены содержат СDR- участки (CDR1, CDR2 и CDR3). |
Микробиологическое производство лекарственныхсредств 213
лочка которых имеет высокое сродство к нужным органам. 2. Встраивают гены специфических токсинов в инфильтрирующие опухоль лимфоциты, которые высвобождают эти токсины непосредственно в опухоли. 3. Присоединяют молекулы лекарственных веществ к моноклональным антителам, специфичным по отношению к белкам, находящимся на поверхности строго определенных клеток, например опухолевых (рис. 10.6). 4. Используют лекарственные вещества в неактивной форме, переводя их в активное состояние при помощи ферментов. Чтобы такое превращение происходило только вблизи клетки-мишени, фермент присоединяют к моноклональному антителу, специфичному к поверхностному антигену этой клетки (рис. 10.6).
Для эффективной работы последней из описанных систем необходимо, чтобы а) моноклональное антитело, связанное с ферментом, переводящим лекарственное вещество в активную форму, было в достаточной степени очищено и имелось в нужном количестве; б) связывалось с высокоспецифичным для клетки-мишени белком; в) было стабильным в физиологических условиях, но в то же время быстро выводилось из кровотока; 2) при необходимости могло проникать в опухолевую ткань, обеспечивая действие препарата на все ее клетки. В этом случае мишенями оказываются строго определенные клетки, что позволяет использовать лекарственное вещество в гораздо меньших дозах, чем при прямом введении. Применение в такой системе моноклональных антител мыши может приводить к развитию иммунного ответа, поэтому очень важно использовать фрагменты антител человека или антител, максимально сходных с ними по структуре.
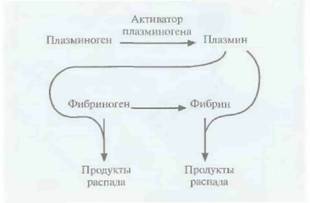
Наиболее частой причиной смерти в странах Северной Америки и Европы является тромбоэмболия мозговых или сердечных артерий. Тромб состоит из молекул фибрина, фактора свертывающей системы крови, образующего сеть в ответ на повреждение сосудистой стенки. E норме молекулы фибрина в образовавшемся тромбе расщепляются с помошью плазмина сериновой протеиназы, который образуется из плазминогена под действием активатора (рис, 10.7), Однако нередко эта биологическая

|
| Рис. 10.6. Схематическое изображение системы целевой доставки лекарственного вещества, основанной на использовании моноклональных антител. А. Молекула лекарственного вещества присоединена к моноклональному антителу. Б. Кмоноклональному антителу присоединен фермент, превращающий инертную форму лекарственного вещества в активную только в непосредственной близости от клетки-мишени. В обоих случаях моноклональное антитело связывается с одним специфическим белком на поверхности клетки -мишени. |
система работает недостаточно эффективно, что приводит к закупорке артерий. В таких ситуациях для повышения уровня плазмина в крови было предложено использовать активатор плазминогена в качестве терапевтического средства.
Однако плазмин способен разрушать и предшественник фибрина фибриноген (рис, 10.7), и если уровень последнего в результате терапии с использованием активатора плазминогена снизится слишком сильно, могут произойти обширные внутренние кровотечения. Это привело к необходимости создания тромболитических препаратов, разрушающих только фибрин в
214 ГЛАВА 10
|
| Рис. 10.7. Активация плазминогена с превращением его в плазмин и разрушение плазмином двух субстратов (фибриногена и фибрина) в крови. |
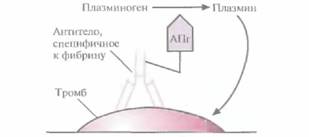
тромбе. Ученые исходили из того, что если к активатору плазминогена «пришить» антитело, специфичное к фибрину, то будет происходить только локальное повышение концентрации плазмина вблизи тромба (рис. 10.8). Для проверки этой гипотезы тканеспецифичный активатор плазминогена был присоединен к моноклональному антителу, специфичному в отношении фибрина. Испытания на модельных системах показали, что комплекс присоединялся к сгусткам крови и лизировал их, не вызывая значительного разрушения фибриногена. Были созданы и другие типы конъюгатов антитело—активатор плазминогена, тоже приводящие к локальному образованию плазмина, разрушающего кровяные сгустки.
|
| Рис. 10.8. Структура иммунотерапевтического тромболитического агента, К моноклональному антителу, специфичному к фибрину, присоединен активатор плазминогена (АПг). Этот комплекс связывается с фибрином, находящимся в тромбе, активатор плазминогена вызывает накопление плазмина вблизи тромба, и плазмин лизирует тромб. |
Моноклональные антитела человека
Несмотря на кажущуюся перспективность иммунотерапии, этот метод имеет и ряд ограничений, связанных с применением моноклональных антител животных и процедурой присоединения к ним нужных молекул. Сам процесс химического присоединения весьма неэффективен, присоединение происходит случайным образом, а кроме того, при этом может снижаться ферментативная активность активатора плазминогена или других веществ, используемых в терапии. И наконец, если предполагается многократное введение препарата, необходимо использовать антитела человека, а не животных, чтобы предотвратить возникновение перекрестных иммунных реакций и сенсибилизацию пациента.
Создание специфических антител, не вызывающих перекрестных реакций, представляет собой довольно трудную задачу, поскольку получение антител человека путем традиционной гибридомной технологии сталкивается с рядом проблем.
• Хромосомы человека в клетках, полученных слиянием лимфоцитов человека с клетками мисломы мыши, нестабильны, поэтому трудно получить клетки, способные вырабатывать моноклональные антитела человека.
• Пока не удалось получить эффективные клеточные линии миеломы человека, которые могли бы заменить мышиные.
• Иммунизация человека различными антигенами не проводится по соображениям этического характера.
Таким образом, для получения антител человека необходимо разрабатывать другие подходы.
В одной из схем B-лимфоциты человека, активно продуцирующие специфические антитела, обработали флуоресцентно меченным антигеном, затем с помощью клеточного сортера провели обогащение образца В-лимфоцитами, вырабатывающими эти антитела. Поскольку В-клетки плохо растут в культуре, для улучшения роста их трансформировали вирусом Эпштейна—Барр. Некоторые клоны трансформированных В-кле-
Микробиологическое производство лекарственных средств 215

|
| Полипептид, обладающий действием лейкоцитарного интерферона человека, синтезируется в Е. coli. |
| S. Nagata, H, Taira, A. Hall, L. Johnsrud, M. Streuli, J. Ecsödi, W. Boll, K. Cantell, C. Weissmann Nature 284: 316-320, 1980 |
| В конце 70-х— начале 80-х гг. молекулярная биотехнология стала Привлекать к себе внимание общественности и крупных инвесторов. Одним из биотехнологических продуктов был интерферон, на который в то время возлагали надежды как на чудодейственное средство против множества вирусных заболеваний и рака. О выделении кДНК интерферона человека и его последующей экспрессии в Escherichia coli сообщали газеты и журналы всего мира. Некоторые особенности интерферона сделали выделение его кДНК особенно сложным. Во- | первых, несмотря на то что интерферон был очищен более чем в 80 000 раз, его удавалось получать лишь в очень небольших количествах, поэтому в то время не была известна его точная мол. масса. Во-вторых, в отличие от многих белков интерферон не обладает легко идентифицируемой химической или биологической активностью: ее оценивали только по снижению цитопатического действия вируса животных на культуру клеток, а это сложный и длительный процесс. В-третьих, в отличие от инсулина было неиз- | вестно, есть ли клетки человека, способные вырабатывать интерферон в достаточно больших количествах, т, е. существует ли источник мРНК интерферона. Несмотря на все эти трудности, в конце концов была выделена и охарактеризована кДНК, кодирующая интерферон. С тех пор было обнаружено несколько разных типов интерферонов. Были выделены гены нескольких интерферонов и показана их эффективность при лечении различных вирусных заболеваний, но, к сожалению, интерферон не стал панацеей. | |||
ток вырабатывают моноклональные антитела человека, взаимодействующие с селектирующим антигеном. К сожалению, выход моноклональных антител был очень небольшим и они обладали низкой антиген связывающей активностью. К тому же вероятность того, что в неиммунизированном организме найдутся секретирующие антитела клетки, которые будут распознавать селектирующий антиген, очень мала.
Еще один подход заключается во введении иммунных клеток человека мутантным мышам, которые практически лишены собственной иммунной системы. После трансплантации иммунных стволовых клеток человека таким мышам, страдающим тяжелым сочетанным иммунодефицитом (scid-мыши), они приобретают клетки иммунной системы человека и в ответ на введение антигена могут вырабатывать антитела человека.
Предпринимаются попытки ввести зародышам мышей гены иммуноглобулинов человека с целью создания транс генных мышей, которые в ответ на иммунизацию конкретным антигеном смогут вырабатывать иммуноглобулины человека. Чтобы получить от трансгенных животных клетки, секретирующие специфические моноклональные антитела, можно использовать стандартную гибридомную технологию, затем провести скрининг таких положительных клеточных линий и определить, какие из них вырабатывают антитела, кодируемые генами иммуноглобулинов человека. Недавно появилось сообщение о том, что уже получена трансгенная мышь, экспрессирующая нативные формы Н- и L-цепей иммуноглобулинов человека.
Трансплантация стволовых клеток иммунной системы человека scid-мышам и получение линий трансгенных мышей — весьма трудоемкие способы производства моноклональных антител человека. Поэтому ученые пытаются создать генноинженерные методы получения антител человека, которые можно использовать в качестве терапевтических средств, и эффективных бифункциональных белков, способных связываться с мишенью и разрушать ее.
Гибридные моноклональные антитела человека и мыши
Тот факт, что разные участки молекулы иммуноглобулина выполняют разные функции, позволяет модифицировать моноклональное антитело
Дата добавления: 2015-07-14; просмотров: 1210;
