ГЛАВА 11
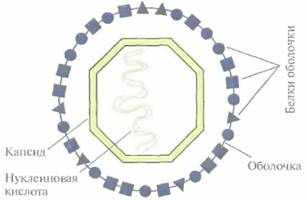
| Рис. 11.1. Строение вируса животных. Геном вируса обычно представлен относительно небольшой молекулой нуклеиновой кислоты (одно- или двухцепочечной ДНК или РНК длиной от 3 до 200 т. п. н.), заключенной в белковый капсид. У некоторых вирусов капсид окружен еще и белковой оболочкой. |
Противогерпетические вакцины
Вирус простого герпеса (HSV, herpes simplex virus) вызывает инфекционные заболевания генерализованного или местного характера (тяжелые поражения глаз, энцефалит, урогенитальные инфекции и т. д.). Кроме того, он является онкогенным, поэтому вакцинация убитым или аттенуированным вирусом сопряжена с определенным риском развития рака. Для защиты от HSV-инфекции можно использовать неонко-генную субъединичную вакцину.
Для создания любой субъединичной вакцины прежде всего нужно идентифицировать те компоненты патогенного микроорганизма, которые индуцируют выработку антител. В случае НSV типа l (HSV-1) таким компонентом является гликопротеин D оболочки (gD). В ответ на введение этого гликопротеина мышам у них вырабатываются антитела, нейтрализующие интактный HSV, Ген gD HSV-1 был изолирован, клонирован в одном из экспрессирующих векторов в клетках млекопитающих и введен в яйцеклетки китайского хомячка (СНО), в которых в отличие от E. coli происходит гликолизирование чужеродных белков. Полноразмерный ген gD кодирует белок, в норме связывающийся с мембраной клетки млекопитающего (рис. 11.2, A). Такой белок труднее очистить, чем раствори-
мый, поэтому ген gD модифицировали, удалив ту его часть, которая кодирует С-концевой трансмембранный домен (рис. 11.2, Б), Затем модифицированным геном трансформировали СНО-клетки, которые гликозилировали белковый продукт и секретировали его во внешнюю среду, поскольку он не мог встраиваться в клеточную мембрану. Лабораторные испытания показали, что антитела, вырабатываемые в ответ на введение модифицированного белка gD, эффективны в отношении как HSV-1, так и HSV-2.
Противоящурные вакцины
Вирус ящура (FMDV, foot-and-mouth disease vims) в высшей степени вирулентен и вызывает массовую гибель крупного рогатого скота и свиней. Для защиты от FMDV-инфекции используют вакцину, содержащую вирус, инактивированный фор-
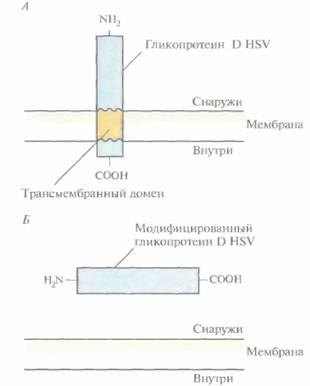
| Рис. 11. 2. А. Молекула gD HSV-1 с транс мембранным доменом, погруженным в плазматическую мембрану. Б. Растворимый белок gD, не содержащий трансмембранного домена. |
Вакцины 231
малином. В мире ежегодно производится примерно 1 млрд. доз этой вакцины.
Основной антигенной детерминантом, индуцирующей образование антител, является вирусный капсидный белок l (VP1, viral protein 1). Это более слабый антиген, чем интактные вирусные частицы, но все же он индуцирует образование антител и обеспечивает защиту животных от инфекции. Поэтому были предприняты попытки клонировать VPl-ген.
Геном FMDV представляет собой одноцепо-чечную РНК. Поэтому сначала синтезировали полноразмерную двухцепочечную кДНК длиной примерно 8000 п, н. Затем ее расщепили с помощью рестрицирующих эндонуклеаз и клонировали полученные фрагменты в экспрессирующем Е. соli-векторе. Продукт кодирующей последовательности VP1 -гена идентифицировали иммунологическими методами как часть слитого (химерного) белка, синтез которого контролируется системой pL-npoMOTOp—cI-penpeccop. Белок состоит из 396 аминокислотных остатков, содержит часть молекулы репликазы бактериофага MS2 и полноразмерный VP1-белок FMDV, благодаря чему он и индуцирует выработку нейтрализующих FMDV антител.
Получить разрешение на применение вакцины, содержащей химерный белок, очень трудно, поэтому, вероятно, придется субклонировать VP1-последовательность в другом экспрессиру-юшем векторе. Так или иначе, субъединичная вакцина против ящура скоро будет готова для проведения доклинических испытаний.
Противотуберкулезные вакцины
Туберкулез — системное инфекционное заболевание, широко распространенное во всем мире. Его возбудителем является бактерия Mycobacterium tuberculosis. Она инфицирует разные ткани и органы (чаще всего легкие) и приводит к гибели клеток. У пациентов наблюдаются лихорадка, потеря веса, а в отсутствие лечения заболевание заканчивается смертью. По оценкам, этим патогенным микроорганизмом инфицировано около 2 млрд. людей, а туберкулез ежегодно уносит примерно 3 млн. жизней. Последние 50 лет для лечения туберкулеза использовали антибиотики, но уже появилось множество устойчивых к ним штаммов М. tuberculosis, так что заболевание, казавшееся побежденным, вновь стало серьезной проблемой.
В настоящее время в ряде стран в качестве противотуберкулезной вакцины используют один из штаммов Mycobacterium bovis, бациллу Кальмета—Герена (BCG, bacillus Calmette—Guérin). Однако эффективность такого подхода вызывает сомнения по двум причинам: 1) живые BCG-клетки могут вызвать серьезное заболевание у лиц со сниженным иммунным статусом (например, у больных СПИДом); 2) лица, которым ввели BCG-вакцину, дают положительный ответ на обычную процедуру выявления вызывающих туберкулез бактерий, что не позволяет отличить их от больных туберкулезом. В связи с этим в некоторых странах, в том числе и в США, BCG-вак-цина к использованию не разрешена. В попытках создания более безопасной и эффективной субъединичной противотуберкулезной вакцины были изучены иммуннопротективные свойства очищенных внеклеточных белков М. tuberculosis, Из жидкой бактериальной культуры выделили и очистили шесть основных из 100 секретируемых белков, и каждый из них по отдельности, а затем различные их комбинации использовали для иммунизации морских свинок. Животным вводили в виде аэрозоля примерно 200 живых клеток М. tuberculosis, что является для них весьма высокой дозой. Через 9—10 нед животных умерщвляли и исследовали их легкие и селезенку на предмет присутствия этой патогенной бактерии. При введении некоторых комбинаций очищенных белков потеря веса, поражение легких и селезенки и уровень смертности были такими же, как и при иммунизации живой BCG-вакциной. Теперь нужно провести сравнение эффективности белков М. tuberculosis, полученных с помощью технологии рекомбинантных ДНК, с эффективностью секреторных белков и разработать безопасную и эффективную вакцину для профилактики туберкулеза у человека.
Пептидные вакцины
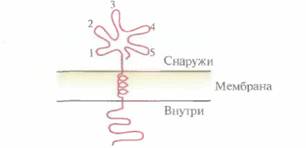
Далее возникает следующий вопрос: может ли небольшой участок белковой молекулы (домен) служить эффективной субъединичной вакциной и индуцировать выработку антител? Интуитивно кажется, что те домены, которые доступны
232 ГЛАВА 11
|
| Рис. 11.3. Обобщенный мембраносвязанный белок, внешние эпитопы (1— 5) которого могут индуцировать иммунный ответ. |
для антитела (т. е. те, которые находятся на поверхности вируса), обладают иммуногенными свойствами, а внутренние домены несущественны, если только они не влияют на конформацию иммуногенного домена (рис. 11.3). Если это предположение верно, то короткие пептиды, имитирующие эпитопы (антигенные детерминанты), можно использовать для создания вакцин.
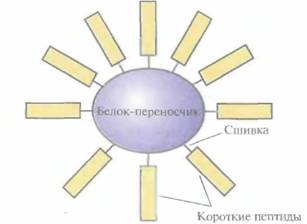
Имея все это в виду, синтезировали химическими методами домены VPI FMDV и проверили возможность создания на их основе пептидных вакцин. Каждый из пептидов, соответствующих аминокислотным остаткам 141—160, 151—160 и 200—213 С-концевого участка VP1 и аминокислотным остаткам 9—24, 17—32 и 25—41 М-концевого участка, сшили по отдельности с инертным
|
| Рис. 11.4. Короткие пептиды, сшитые с белком-переносчиком и служащие основой пептидной вакцины. |
белком-переносчиком (гемоцианином моллюска фиссурелии), чтобы предотвратить их разрушение, и ввели морским свинкам (рис. 1 l .4). Синтез антител в количестве, достаточном для зашиты животного от последующих FMDV-инфекций, наблюдался только при введении пептида 141—160. Введение же целого VP1 или пептидов 9—24, 17—32 и 25—41 индуцировало синтез антител в меньших количествах.
Более длинный пептид, состоящий из аминокислотных остатков 141 — 158 и 200—213, которые были соединены двумя пролиновыми остатками, индуцировал эффективный синтез антител у морских свинок даже в том случае, когда он не был сшит с белком-носителем. Эта «двухпептидная» молекула оказалась эффективнее любого изолированного пептида и блокировала пролиферацию FMDV у крупного рогатого скота и морских свинок.
Эти результаты являются весьма многообещающими, однако количество (доза) пептидного материала, необходимого для индукции иммунного ответа, примерно в 1000 раз выше, чем в случае убитой FMDV-вакцины. Чтобы решить эту проблему, фрагмент ДНК, кодирующий пептид из аминокислотных остатков 142—160 VPI FMDV, сшили с геном, кодирующим коро-вый белок гепатита В (HBcAg). При экспрессии этого химерного гена в E. coli или культуре животных клеток его продукты — белковые молекулы — в процессе самосборки образовывали стабильные «27нм-частицы», на поверхности которых находился пептид из VPI FMDV. Эти частицы обладали высокой иммуногенностью. Таким образом, H BcAg можно использовать в качестве эффективной молекулы-носителя синтетических пептидов. Сравнение иммуногенности различных пептидных FMDV-вакцин, содержащих домен 142—160 VPl-белка, проведенное на морских свинках, показало, что иммуногенность химерного белка, состоящего из HBcAg и указанного домена, в 10 раз ниже, чем у инактивироваиных FMDV-частиц, в 35 раз выше, чем у химерного белка, содержащего ß-галактозидазу Е. colt и домен 137-162 из VPI FMDV, и в 500 раз выше, чем у свободного синтетического пептида, состоящего из аминокислотных остатков 142—160. Поскольку синтетический пептид, сшитый с HBcAg, образует 27нм-частицы, сход-
Вакцины 233
ные с вирусом гепатита В, и они обладают почти такой же иммуногенностью, как и интактный вирус, на основе которого получен синтетический пептид, этот подход может стать основным способом доставки пептидных вакцин к месту их действия.
И все же существует несколько ограничений на использование коротких пептидов в качестве вакцин.
• Эпитоп, использующийся для создания эффективной пептидной вакцины, должен представлять собой короткий, но непрерывный участок белковой молекулы, а это бывает не всегда.
• Конформация пептида должна быть такой же, как у эпитопа в интактной вирусной частице.
• Изолированный эпитоп может не обладать достаточной иммуногенностью. В будущем синтетические пептидные вакцины могут стать высокоспецифичной, относительно недорогой, безопасной и эффективной альтернативой традиционным вакцинам, хотя для этого необходимо провести еще немало исследований.
Генная иммунизация
Новый подход, позволяющий индуцировать у организма иммунный ответ без введения антигена, основан на включении в клетки животного-мишени гена, кодирующего белок-антиген. В первых экспериментах такого рода E. coli-плазмиду, содержащую клонированный ген белка-антигена, транскрипция которого находилась под контролем промотора вируса животных, конъюгировали с микрочастицами золота и бомбардировали ими клетки уха мыши. Впоследствии выяснилось, что клонированную кДНК можно вводить в клетки и с помощью внутримышечной инъекции раствора с большим количеством плазмиды, несущей соответствующую ДНК, Для этого необходимо в 103-104 раз больше ДНК, чем при бомбардировке микрочастицами. В одном из экспериментов более чем в 75% случаев ген включался в клетки мыши, и синтезированный белок-антиген индуцировал синтез антител. Этот подход позволяет избежать очистки антигена, что требует много времени и средств, или использования для создания вакцины технологии рекомбинантных ДНК. Кроме того, получаемые с его помощью белки с большей вероятностью подвергаются правильной посттрансляционной модификации, чем белки, синтезируемые организмами-хозяевами. Этот метод, получивший название генной иммунизации, можно использовать для вакцинации домашних животных.
Перспективы генной иммунизации были тщательно изучены. В одной из серий экспериментов мышам в квадрицепсы обеих задних конечностей вводили раствор с Е. соli-плазмидой, несущей кДНК нуклеопротеина вируса гриппа А, транскрипция которой находилась под контролем промотора вируса саркомы Рауса или цитомегаловируса. Хотя уровень экспрессии гена нуклеопротеина был настолько низок, что не поддавался регистрации, через 2 нед после иммунизации в крови мышей обнаруживались антитела к нему. Выживаемость иммунизированных мышей оказалась значительно выше, чем мышей из контрольной группы (рис, 11.5). Более того, они были нечувствительны и к другому штамму вируса гриппа. Такая перекрестная защита не вырабатывается при введении традиционных противогриппозных вакцин, полученных на основе поверхностных антигенов вируса, и поэтому каждая вакцина специфична лишь к одному штамму вируса. Более того, традиционные вакцины сохраняют свою эффективность только до тех пор, пока остаются неизмененными поверхностные антигены, К сожалению, для генов поверхностных антигенов характерна высокая частота мутаций, что приводит к появлению существенно различающихся штаммов вируса. Коровые же белки, такие как нуклепротеин, относительно стабильны и активируют иммунную систему по другому механизму, чем поверхностные антигены.
ДНК-иммунизация позволяет не только избежать очистки белковых антигенов, но и индуцировать иммунный ответ, направленный именно на кодируемый плазмидой белок, а не на саму плазмиду. Поэтому один и тот же вектор можно использовать для доставки разных белков или для многократного введения одного и того же гена.
Судьба введенной в клетку ДНК точно неизвестна. В принципе она может интегрировать в
Дата добавления: 2015-07-14; просмотров: 682;
