Вакцины 237
| Рис. 11.6. Создание штамма V. cholerae с делецией части нуклеотидной последовательности, кодирующей А1-пептид холерного токсина. | 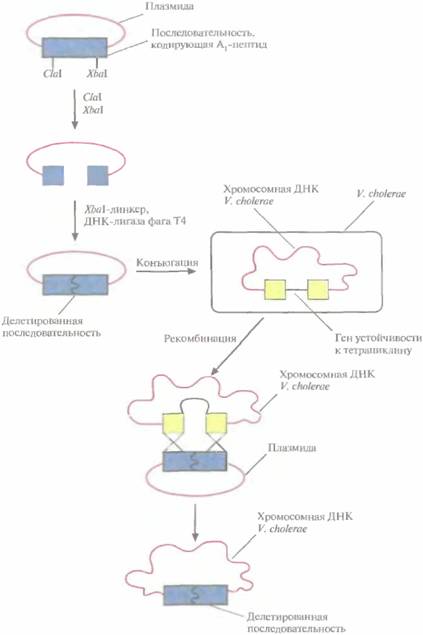
|
пероральные вакцины для мышей, овец, крупного рогатого скота, цыплят, а совсем недавно — и для человека.
Противолейшманиозные вакцины
Простейшие паразиты Leishmania тоже могут вызывать у человека развитие иммунного ответа, однако создание эффективных вакцин против них представляет собой нелегкую задачу. С этой целью можно использовать аттенуированные линии Leishmania, но они часто ревертируют и становятся вирулентными, а кроме того, могут длительное время бессимптомно персистировать в организме человека — резервуаре инфекции - и передаваться другим людям. Чтобы решить эти проблемы, попытались создать атте-
238 ГЛАВА 11
нуированную неревертирующую линию Leishmania с помощью делеции одного из важных для метаболизма генов (например, гена дигидрофолатредуктазы—тимидилатсинтазы). У одного из таких паразитов, Leishmania major Е10-5АЗ, два гена дигидрофолатредуктазы—тимидилатсинтазы были заменены генами устойчивости к антибиотикам G-418 и гигромицину. В отличие от паразитов дикого типа, при выращивании L. major E10-5A3 в обычной культуре или в культуре макрофагов в среду необходимо добавлять тимидин (рис. 11.7). В организме мышей BALB/c паразиты оставались жизнеспособными в течение нескольких дней, что достаточно для создания стойкого иммунитета у животных (рис. 11.8), но недостаточно для развития заболевания. Ни персистирующая инфек-

| Рис. 11.7. Пролиферация L. major дикого типа и аттенуированного паразита в мышиных макрофагах. Для инвазии в обоих случаях использовали одинаковое количество L. major, находящихся в стационарной фазе. (Из работы Titus et al., Proc. Natl. Acad. Sci. USA92: 10267-10268, 1995, с изменениями.) |
ция, ни заболевание не возникали даже у наиболее чувствительных видов мышей, так что данная линия вполне подходит для создания вакцины. Проведя дополнительные эксперименты на животных, можно будет проверить ее эффективность при иммунизации человека.
«Векторные» вакцины
Противовирусные вакцины
В качестве эффективной живой противооспенной вакцины широко используют вирус коровьей оспы (ВКО), относящийся к роду поксвирусов. Геном этого вируса полностью секвенирован; он представляет собой двухцепочечную ДНК длиной 187 т.п.н., кодирующую примерно 200 разных белков. ДНК ВКО реплициру-
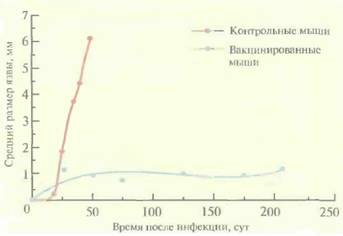
| Рис. 11.8. Иммунитет к вирулентному паразиту L. major, вырабатывающийся у мышей BALB/c после инвазии аттенуированного паразита L. major, В момент времени 0 мышей, предварительно вакцинированных аттенуированным паразитом, заражали вирулентным паразитом, а затем определяли средний размер лейшманиозных язв. Контрольных мышей не вакцинировали. (Из работы Titus et al., Proc. Natl. Acad. Sci. USA 92: 10267-10268, 1995, с изменениями.) |
Вакцины 239
ется в цитоплазме инфицированных клеток, а не в ядре, благодаря наличию у вируса генов ДНК-полимеразы, РНК-полимеразы и ферментов, осуществляющих кэпирование, метилирование и полиаденилирование мРНК. Поэтому, если в геном ВКО встроить чужеродный ген, так чтобы он находился под контролем ВКО-промотора, то он будет экспрессироваться независимо от регуляторных и ферментных систем хозяина.
ВКО имеет широкий спектр хозяев (позвоночных и беспозвоночных), остается жизнеспособным в течение многих лет после лиофилизации (испарения воды с помощью замораживания) и не обладает онкогенными свойствами, а потому может использоваться для создания так называемых векторных вакцин. С их помощью осуществляется доставка и экспрессия в организме-хозяине клонированных генов, кодирующих антигенные белки, которые индуцируют выработку протективных антител. Геном ВКО имеет большие размеры и не содержит уникальных сайтов рестрикции, что не позволяет встраивать в него дополнительные нуклеотидные последовательности. Однако нужные гены можно вводить в геном ВКО с помощью гомологичной рекомбинации in vivo следующим образом.
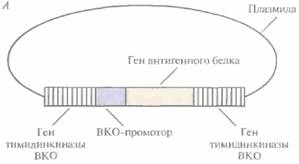
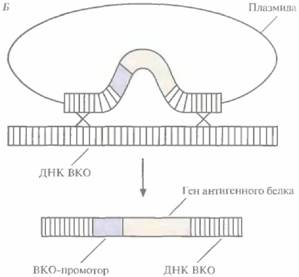
1. Сегмент ДНК, кодирующий специфичный антиген (например, HBcAg), встраивают в плaзмидный вектор непосредственно после клонированного ВКО-промотора, включенного в какой-либо несущественный ген ВКО, например ген тимидинкиназы (рис. 11.9, А).
2. Этой плазмидой трансформируют культуру дефектных по тимидинкиназе животных клеток, обычно фибробластов куриного эмбриона, предварительно инфицированных ВКО дикого типа, который синтезирует функциональную тимидинкиназу,
3. В результате рекомбинации между нуклеотидными последовательностями, фланкирующими промотор и ген протективного антигена, и гомологичными последовательностями вирусного генома происходит встраивание клонированного гена в вирусную ДНК (рис. 11.9, Б). Частота таких рекомбинаций невысока, однако популяцию клеток, содержащих реком-
|
|
| Рис. 11.9. Встраивание в ДНК ВКО гена, белковый продукт которого (обычно вирусный антиген) индуцирует иммунный ответ. А. Плазмида, несущая ген антигенного белка, способный экс премироваться Б. Двойной кроссинговер, приводящий к встраиванию этого гена в ДНК ВКО. |
бинантный ВКО, можно обогатить, используя селективную среду с бромдезоксиуридином. Этот токсичный аналог тимидина в отсутствие тимидинкиназы не включается в синтезируемую ДНК и не оказывает токсического действия. Дефектные по тимидинкиназе клетки-хозяева, которые содержат обычный ВКО, в присутствии бромдезоксиуридина погибают, а клетки, несущие рекомбинантный ВКО с разрывом в гене ти-
240 ГЛАВА 11
мидинкиназы, становятся устойчивыми к его токсическому действию.
4. Проводят окончательный отбор с помощью ДНК-зонда, гибридизующегося с геном антигенного белка.
Поскольку дефектные по тимидинкиназе ВКО спонтанно возникают с относительно высокой частотой (примерно 1 на 103—104 вирусных частиц), нередко проводят котрансфекцию клеток каким-либо селективным маркером и нужным геном. Это облегчает разграничение спонтанных мутантов и мутантов, полученных с помощью гомологичной рекомбинации. В качестве селективного маркера обычно используют ген пео, кодирующий фермент неомицин-фосфотрансферазу [I и обеспечивающий устойчивость к аналогу канамицина G-418. Этот ген, в отличие от других селективных маркеров, остается стабильным при встраивании в геном ВКО.
Разработана специальная система, позволяющая избежать прерывания рамки считывания генов ВКО при встраивании чужеродного гена. При этом отпадает необходимость в использовании селективных маркеров, поскольку каждый образующий бляшку рекомбинантный вирус будет содержать и экспрессировать ген-мишень. ДНК ВКО дикого типа несет ген νρ37, отвечающий за образование бляшек при росте вируса в монослойной культуре животных клеток (рис. 11.10, А). Если заменить этот ген маркерным геном Е. соli, то образуется мутантный ВКО, который не формирует бляшки при выращивании его в течение 2—3 сут в культуре животных клеток (рис. 11.10, Б). Ген-мишень вводят в этот мутантный вирус с помощью гомологичной рекомбинации его ДНК с вектором, несущим ген νρ37 и ген-мишень (рис. 11.10, В). Мутантный ВКО, получивший ген νρ37, приобретает способность к образованию бляшек, при этом в его геном встраивается ген-мишень, а маркерный ген утрачивается. Мутантный вирус с делегированным геном vp37 не может ревертировать к дикому типу, поэтому каждая вирусная частица, образующая бляшку, содержит желаемую конструкцию. Этот метод прост, применим для переноса и экспрессии любого гена-мишени, не требует каких-либо дополнительных маркерных генов и не прерывает рамку считывания генов ВКО.
В геном ВКО уже удалось встроить и экспрессировать в культуре животных клеток несколько генов антигенных белков: G-белка ви-
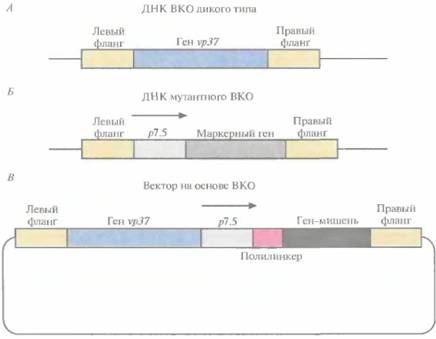
| Рис. 11.10. А. ДНК ВКО дикого типа. Е. ДНК мугантного ВКО. В. Вектор на основе ВКО. Левый фланг и правый фланг — последовательности, примыкающие слева и справа соответственно к гену νρ37 в геноме ВКО дикого типа. Промотор vp37 не показан, p 7. 5 -- сильный «ранний» (или «поздний») ВКО-промотор. Ген-мишень встроен в полилинкер. Гомологичная рекомбинация между рекомбинантным вектором и ДНК мугантного вируса приводит к замене маркерного гена Е. coli на ген vp37 и ген -мишень. |
Вакцины 241
руса бешенства, поверхностного антигена гепатита В, поверхностных белков вируса Синдбис, NP- и НА-белков вируса гриппа, N- и G-белков вируса везикулярного стоматита, гликопротеинов вируса простого герпеса. Некоторые из полученных на основе ВКО рекомбинантных векторов можно использовать для создания эффективных вакцин. Так, рекомбинантный ВКО, экспрессирующий ген гликопротеина D вируса простого герпеса типа 1, предотвращает герпесные инфекции у мышей, а рекомбинантный ВКО, экспрессирующий ген поверхностного антигена вируса бешенства, индуцирует выработку протективных антител у лис, основных переносчиков вируса бешенства в Европе.
Векторные ВКО-вакцины позволяют провести иммунизацию сразу от нескольких заболеваний. Для этого можно использовать рекомбинантный ВКО, который несет несколько генов, кодирующих разные антигены.
В зависимости от используемого ВКО-промотора чужеродный белок может синтезироваться в ранней или поздней фазе инфекционного цикла, при этом его количество определяется силой промотора. Обычно для достижения высокого уровня экспрессии используют «поздние» ВКО-промоторы: p11 (промотор гена, отвечающего за синтез белка мол. массой 11 кДа) или рСАЕ (промотор гена интегрального белка вируса коровьей оспы типа А). При встраивании в одну ДНК ВКО нескольких чужеродных генов каждый из них помещают под контроль отдельного ВКО-промотора, чтобы предотвратить гомологичную рекомбинацию между различными участками вирусной ДНК, которая может привести к утрате встроенных генов.
Живая рекомбинантная вирусная вакцина имеет ряд преимуществ перед неживыми вирусными и субъединичными вакцинами: 1) презентация аутентичного антигена практически не отличается от таковой при обычной инфекции; 2) вирус может реплицироваться в клетке-хозяине и увеличивать количество антигена, который активирует продукцию антител В-клетками (гуморальный иммунитет) и стимулирует выработку Т-клеток (клеточный иммунитет); 3) встраивание генов антигенных белков в один и большее число сайтов генома ВКО еще больше уменьшает его вирулентность.
Недостаток живой рекомбинантной вирусной вакцины состоит в том, что при вакцинации лиц со сниженным иммунным статусом (например, больных СПИДом) у них может развиться тяжелая вирусная инфекция. Чтобы решить эту проблему, можно встроить в вирусный вектор ген, кодирующий человеческий интерлейкин-2, который стимулирует Т-клеточный ответ и ограничивает пролиферацию вируса.
Нежелательные побочные эффекты пролиферации ВКО можно предупредить инактивацией вируса после вакцинации. Для этого был создан чувствительный к интерферону вирус (ВКО дикого типа относительно устойчив к его действию), пролиферацию которого можно регулировать в случае возникших при вакцинации осложнений.
Механизм устойчивости ВКО к интерферону оставался неустановленным, пока не была обнаружена открытая рамка считывания K3L, кодирующая белок мол. массой 10,5 кДа. Этот белок содержит аминокислотную последовательность, гомологичную N-концевой части эукариотического фактора инициации elF-2α мол. массой 36,1 кДа. N-концевые области обоих белков содержат 87 практически идентичных аминокислотных остатков, причем в положении 51 в обоих случаях находится серии, который в elF-2α фосфорилируется активируемой интерфероном Р1-киназой, что приводит к ингибированию синтеза белка в обработанных интерфероном клетках. К3L-белок действует как конкурентный ингибитор фосфорилирования elF-2α, обеспечивая устойчивость ВКО к интерферону, и если из генома ВКО удалить ген K3L или его часть, то вирус станет чувствительным к интерферону, С помощью ΠЦР-мутагене за гена K3L, находящегося в составе плазмиды, и последующей гомологичной рекомбинации между ДНК ВКО и плазмидой с целью замены К3L-последовательности дикого типа модифицированным вариантом был сконструирован мутантный ВКО K3L~ . Этот штамм оказался в 10—15 раз более чувствительным к интерферону, чем штамм дикого типа (рис. 11.11). Эта работа является важным этапом на пути создания более безопасных ВКО-векторов. Последовательности, сходные с K3L, могут содержать и другие устойчивые к интерферону вирусы, что позволит с помощью де-
242 ГЛАВА 11
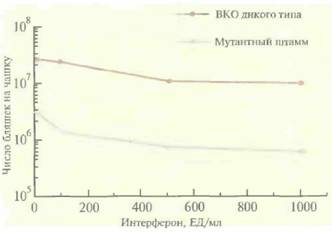
| Рнс. 11.11. Чувствительность к интерферону ВКО дикого типа (K3L+) и мутантного штамма (K3L~). Мышиные клетки L929 перед инокуляцией вирусом обрабатывали в течение 24 ч смесью мышиных альфа- и бета-интерферонов. На каждой чашке, не обработанной интерфероном, было примерно 3-107 бляшек. (Paoletti, Tartaglia, U.S. patent 5,378,657, 1995, с изменениями). |
леций создавать их штаммы, чувствительные к интерферону.
Большинство работ по созданию живых вирусных вакцин проводились на ВКО, однако в качестве кандидатов на роль векторов для вакцинации рассматриваются и другие вирусы: аденовирус, полиовирус и вирус ветряной оспы. Вектор на основе живого аттенуированного полиовируса (его исследования только начинаются) привлекателен тем, что позволяет проводить пероральную вакцинацию. Такие «слизистые» вакцины (вакцины, компоненты которых связываются с рецепторами, расположенными в легких или желудочно-кишечном тракте) пригодны для профилактики самых разных заболеваний: холеры, брюшного тифа, гриппа, пневмонии, мононуклеоза, бешенства, СПИДа, болезни Лайма. Но до любых клинических испытаний любого на первый взгляд безобидного вируса как системы доставки и экспрессии соответствующего гена необходимо убедиться в том, что он действительно безопасен. Например, повсеместно используемый ВКО вызывает у людей осложнения с частотой примерно 3,0-10-6. Поэтому из генома рекомбинантного вируса, который предполагается использовать для вакцинации человека, желательно удалить последовательности, ответственные за вирулентность.
Противобактериальные вакцины
Для лечения заболеваний, вызываемых бактериями, широко используются антибиотики, и лишь совсем недавно начались работы по созданию противобактериальных вакцин. Стимулом к этому стали весьма веские причины.
• Не все бактериальные инфекции поддаются лечению антибиотиками.
• Широкое использование антибиотиков в последние 40 лет привело к появлению большого числа устойчивых к ним бактериальных штаммов.
• Во многих тропических странах отсутствуют условия для хранения антибиотиков.
• Часто больные прекращают лечение раньше, чем это предписано врачом, или принимают антибиотики в недостаточной дозе.
Имея в виду, что создаваемая противобактериальная вакцина должна быть достаточно эффективной, важно выбрать правильную стратегию. Если патогенная бактерия плохо растет в культуре и сложно получить ее аттенуированный штамм, необходимо использовать альтернативные способы. Например, Rickettsia rickettsii, грамотрицательная облигатная внутриклеточная бактерия, вызывающая пятнистую лихорадку Скалистых гор, не растет в культуре. Чтобы обойти эту трудность, создали субъединичную вакцину, содержащую основной поверхностный антиген R. rickettsii, белок мол. массой 155 кДа. Она эффективно защищала мышей от этой патогенной бактерии.
Бактерии кок системы доставки антигенов
Антигены, находящиеся на наружной поверхности бактериальной клетки, обладают более высокой иммуногенностью, чем локализованные в цитоплазме. Поэтому один из подходов, исполь-
Дата добавления: 2015-07-14; просмотров: 1031;
