Энергия Гельмгольца.
Энергия Гельмгольца (изохорно-изотермический потенциал) является характеристической функцией, если независимыми переменными выбраны объем и температура. Полный дифференциал энергии Гельмгольца для простых систем записывается в виде:
 , (4.56)
, (4.56)
а в случае обратимых процессов как
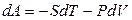 . (4.57)
. (4.57)
Полагая V = const, из уравнения (4.57) получаем
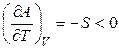 ,
, 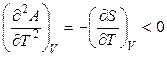 . (4.58)
. (4.58)
Функция А = f (T) при V = const является убывающей, а кривая зависимости энергии Гельмгольца от температуры при постоянном объеме обращена выпуклостью вверх (рис. 4.3). Мерой убыли энергии Гельмгольца при повышении температуры вещества является энтропия.
Полагая Т = const, из уравнения (4.57) получаем
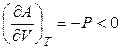 ,
, 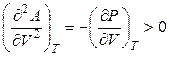 . (4.59)
. (4.59)
Функция А = f (V) при T = const также является убывающей, но кривая зависимости энергии Гельмгольца от объема при постоянной температуре обращена выпуклостью вниз (рис. 4.3).

Рис.4.3. Зависимость энергии Гельмгольца от температуры и объема.
При протекании обратимых процессов в сложных системах, способных выполнять кроме работы расширения и другие виды работы (полезную работу), справедливо:
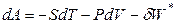 . (4.60)
. (4.60)
Если процесс изотермический (Т = const), то
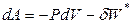 ,
,
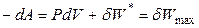 ,
, 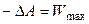 . (4.61)
. (4.61)
Итак, в обратимом изотермическом процессе убыль энергии Гельмгольца равна максимальной (полной) работе, производимой системой. В этом заключается основной смысл введения новой функции А: через изменение функции состояния в изотермических условиях можно определить максимальную работу в обратимом процессе.
Если обратимый процесс протекает в изохорно-изотермических условиях, то
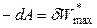 ,
,  . (4.62)
. (4.62)
В обратимом изохорно-изотермическом процессе убыль энергии Гельмгольца равна максимальной полезной работе.
Рассмотрим систему и окружающую среду, которые находятся в тепловом равновесии: Тсист. = Тср.. Пусть в системе протекает процесс, в результате которого в окружающую среду переходит количество теплоты δQcр.. Тогда общее изменение энтропии dSобщ (ее называют изменением энтропии вселенной) равно:
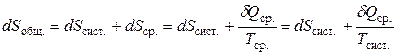 .
.
Поскольку теплота уходит из системы, то δQcр. = –δQсист., поэтому
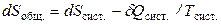 .
.
Но dSобщ. положительно для любого самопроизвольного (необратимого) процесса и равно нулю при равновесии. Следовательно,
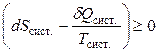 . (4.63)
. (4.63)
Значение неравенства (4.63) состоит в том, что оно выражает критерий самопроизвольного изменения только через свойства системы. Если система теряет теплоту при постоянном объеме, то
δQV = dU,
поэтому соотношение (4.63) принимает вид:
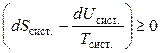 или
или 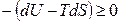 . (4.64)
. (4.64)
В последнем соотношении нижний индекс опущен, поскольку все величины относятся к системе. Следует понимать, что dS – это изменение энтропии системы, а ‑dU/T – изменение энтропии среды: суммарная энтропия стремится к максимуму.
Поскольку в конечном итоге рассматривается изохорно-изотерми-ческий процесс, то
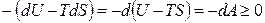 .
.
Следовательно, при протекании процессов в изохорно-изотермических условиях должно выполняться неравенство
 , (4.65)
, (4.65)
где знак равенства относится к обратимым процессам, а знак неравенства – к необратимым.
Далее, для обратимого изотермического процесса
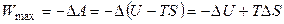 . (4.66)
. (4.66)
Если в обратимом процессе энтропия системы увеличивается, то максимальная работа больше, чем –ΔU, так как TΔS положительно. Система не изолирована и поэтому в нее может поступать теплота, служащая источником энергии для производства работы. Если же ΔS отрицательно, то теплота должна выделяться из системы, чтобы привести к общему увеличению энтропии (энтропии вселенной). Поэтому не все изменение внутренней энергии может перейти в работу и Wmax < (–ΔU).
Дата добавления: 2015-08-20; просмотров: 1201;
